
【题目】下列有机实验操作或叙述正确的是( )
A.将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色
B.甲烷和氯气在室温下的黑暗环境中可以稳定存在
C.苯能使溴水退色是因为二者反应生成了溴苯
D.要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,收集一试管甲烷和氯气的混合气体,照后观察到量筒内形成一段水柱,认为有氯化氢生成。
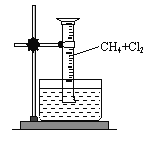
(1)该反应的反应类型为
(2)该反应的化学方程式为(只写第一步) ;
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)你认为该实验设计得出的结论是否正确的 ,
若不正确,理由是:
【实验三】
步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要氧化物,具有特殊的性质。下面是某化学学习小组对二氧化硫性质的验证实验。
(1)实验用品:分液漏斗、__________(玻璃仪器名称)、试管、具支试管、玻璃导管、乳胶管;亚硫酸钠晶体、硫酸(75%~90%)、NaOH稀溶液、NaOH浓溶液、酸性KMnO4溶液、Na2S稀溶液、酚酞试剂。
(2)实验装置

装置图中分液漏斗内的试剂是_________________________。
(3)实验步骤
①按照图示装置连接好实验仪器,检查装置气密性。检查方法是_____________________。
②在具支试管Ⅱ、Ⅲ、Ⅳ中分别加入2 mL NaOH稀溶液(溶液中滴有酚酞试剂)、2 mL酸性KMnO4溶液、2 mL Na2S稀溶液。其中Ⅱ中的实验现象是_____________________________;
Ⅲ中现象说明SO2具有__________性;Ⅳ中若持续通入SO2,写出发生反应的化学方程式:__________________________________。
(4)如果将具支试管Ⅲ内的酸性KMnO4溶液换为氯水,那么具支试管Ⅲ中发生反应的现象是_______________________,发生反应的离子方程式是_________________________。
(5)试管Ⅴ中加入的是NaOH浓溶液,其作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________。
(2)分子式为C9H20的某烃其一氯代物只有两种产物,写出符合要求的结构简式________________。
(3)分子式为C5H10的烯烃中不存在顺反异构的物质有_____种。
(4)已知烯烃、炔烃在臭氧作用下发生以下反应:

某烃化学式为C10H10,在臭氧作用下发生反应:C10H10![]() CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
②C10H10结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.CaCl2=Ca2++Cl2
B.Na2SO4=Na++SO42﹣
C.HNO3=H++NO3﹣
D.KOH=K++O2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程,反应条件略。下列说法不正确的是

A. 途径l发生的反应是SO2+H2O2=H2SO4
B. 途径2增大O2的浓度可提高SO3的产率和SO2的转化率
C. ImolS完全反应生成SO3所放出的热量即为S的燃烧热
D. 若△H1<△H2+△H3,则2 H2O2 (aq)=2 H2O(aq)+ O2 (g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应: 2 N2O5 (g)![]() 4NO2 (g) +O2 (g)△H=+QkJ/mol(Q>0),一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g) +O2 (g)△H=+QkJ/mol(Q>0),一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /mol/L | 1.0 | 0.7 | 0.5 | 0.5 |
下列说法中正确的是
A. 500s时O2的浓度为0.35 mol/L
B. l000s肘将容器的体积缩小一半,重新达到平衡时0.5mol/L< c (N2O5)<1.0 mol/L
C. 平衡后,升高温度,正反应速率先增大后减小至平衡
D. 相同温度下,若起始充入了参与反应的三种气体各0. 5mol/L,则反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列气体在氧气中充分燃烧后,其产物既可使无水硫酸铜变蓝色,又可使澄清石灰水变浑浊的是( )
A. 二氧化碳 B. 甲烷 C. 氢气 D. 一氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com