
【题目】下列属于放热反应的是( )
A. 浓硫酸的稀释 B. 铝热反应
C. 氢气还原氧化铜 D. Ba(OH)22H2O和NH4Cl(固体)混合
科目:高中化学 来源: 题型:
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
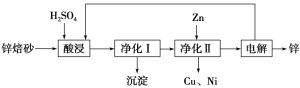
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)__________________ ________。
(2)混合溶液中由水电离出的c(OH-)______0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________________mol·L-1,
c(OH-)-c(HA)=________________mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”);同温度下等浓度的下列四种盐溶液,按pH由大到小的顺序排列是__________________(填序号)。
A.NH4HCO3 B.NH4A
C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++CO32﹣= CO2↑+H2O的化学反应的组合共有( )
A.6个 B.9个 C.12个 D.15个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)计算:
(1)2mol Na2CO3的质量是 g。
(2)标准状况下11.2 L N2所含分子数是 个。
(3)将80gNaOH溶于水形成1L溶液,所得溶液中NaOH的物质的量浓度 mol/L。
(4)现有100 ml 1.00 mol/L NaCl溶液,所含NaCl固体的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们对CO2的应用研究日新月异。
(1)合成尿素的原料是CO2和NH3,合成原理分两步:
①合成氨基甲酸铵:CO2(g)+2NH3(g)===NH2COONH4(s) ΔH=-159.47 kJ/mol
②氨基甲酸铵分解:NH2COONH4(s)===CO(NH2)2(s)+H2O(l) ΔH=+28.49 kJ/mol
则2 mol CO2完全反应合成尿素所________(填“吸收”或“释放”)的热量为________。
(2)最近科学家们研制成功一种新型催化剂,能将CO2转变为甲烷。在常压,300 ℃,CO2与H2体积比为1∶4时反应,CO2转化率达90%。
①写出此反应的化学方程式:_______________________。
②某兴趣小组,在一定条件下,在体积为V L的密闭容器中,模拟发生此反应达到化学平衡状态。该反应的平衡常数表达式为__________________________;
由下图可知升高温度,K将________(填“增大”、“减小”或“不变”);300 ℃时,从反应开始到达到平衡,以H2的浓度变化表示化学反应速率:______________(用nA、tA、V表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机实验操作或叙述正确的是( )
A.将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色
B.甲烷和氯气在室温下的黑暗环境中可以稳定存在
C.苯能使溴水退色是因为二者反应生成了溴苯
D.要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com