
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
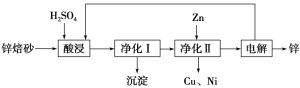
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
【答案】(1)ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O (2)①H2O2+2Fe2++2H+===2Fe3++2H2O ②4.0×10-5 ③Fe(OH)3胶体具有吸附性
(3)H2SO4、Zn (4)制取的锌含铜、镍等杂质
【解析】(1)根据信息,酸浸时ZnFe2O4会生成两种盐,这两种盐分别为硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应的化学方程式为ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O。(2)①亚铁离子被双氧水氧化成铁离子,反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O;②氢氧化铁的溶度积Ksp[Fe(OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11 mol·L-1,c(Fe3+)=![]() mol·L-1=4.0×10-5 mol·L-1。(3)通过制取金属锌的流程图可知,可以循环利用的物质除硫酸锌外,还有硫酸、锌。(4)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,酸浸后溶液中存在钙离子、亚铁离子、铜离子、镍离子,如果没有净化Ⅱ操作,则电解制取的锌中会含有铜、镍等杂质。
mol·L-1=4.0×10-5 mol·L-1。(3)通过制取金属锌的流程图可知,可以循环利用的物质除硫酸锌外,还有硫酸、锌。(4)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,酸浸后溶液中存在钙离子、亚铁离子、铜离子、镍离子,如果没有净化Ⅱ操作,则电解制取的锌中会含有铜、镍等杂质。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由NH![]() 、Ba2+、Mg2+、H+、OH-、Cl-、HCO
、Ba2+、Mg2+、H+、OH-、Cl-、HCO![]() 、SO
、SO![]() 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A.甲溶液含有Ba2+ B.乙溶液含有SO![]()
C.丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对核外电子运动状况的描述正确的是( )
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,收集一试管甲烷和氯气的混合气体,照后观察到量筒内形成一段水柱,认为有氯化氢生成。
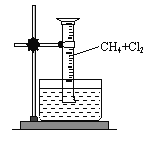
(1)该反应的反应类型为
(2)该反应的化学方程式为(只写第一步) ;
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)你认为该实验设计得出的结论是否正确的 ,
若不正确,理由是:
【实验三】
步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com