
【题目】下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是 ( )
A. 同周期元素,随着核电荷数的增加,I1总体上呈现由小到大的变化趋势
B. 电离能越大,表示气态时该原子越易失电子
C. 元素的电负性越大,表示其原子在化合物中吸引电子能力越强
D. 电负性是相对的,所以没有单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )

A.图2装置中Cu电极上发生的电极反应式为:Cu-2e-==Cu2+
B.图1为原电池装置,Cu电极上产生的是O2
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电流均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
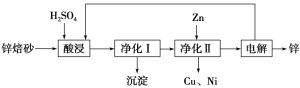
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H=______kJmol-1.
(2)一定条件下,将NO2与SO2以物质的量比为1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。[不考虑N2O4(g)![]() 2NO2(g)的转化]
2NO2(g)的转化]
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2物质的量比为1:6,则平衡时SO2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)__________________ ________。
(2)混合溶液中由水电离出的c(OH-)______0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________________mol·L-1,
c(OH-)-c(HA)=________________mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”);同温度下等浓度的下列四种盐溶液,按pH由大到小的顺序排列是__________________(填序号)。
A.NH4HCO3 B.NH4A
C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++CO32﹣= CO2↑+H2O的化学反应的组合共有( )
A.6个 B.9个 C.12个 D.15个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们对CO2的应用研究日新月异。
(1)合成尿素的原料是CO2和NH3,合成原理分两步:
①合成氨基甲酸铵:CO2(g)+2NH3(g)===NH2COONH4(s) ΔH=-159.47 kJ/mol
②氨基甲酸铵分解:NH2COONH4(s)===CO(NH2)2(s)+H2O(l) ΔH=+28.49 kJ/mol
则2 mol CO2完全反应合成尿素所________(填“吸收”或“释放”)的热量为________。
(2)最近科学家们研制成功一种新型催化剂,能将CO2转变为甲烷。在常压,300 ℃,CO2与H2体积比为1∶4时反应,CO2转化率达90%。
①写出此反应的化学方程式:_______________________。
②某兴趣小组,在一定条件下,在体积为V L的密闭容器中,模拟发生此反应达到化学平衡状态。该反应的平衡常数表达式为__________________________;
由下图可知升高温度,K将________(填“增大”、“减小”或“不变”);300 ℃时,从反应开始到达到平衡,以H2的浓度变化表示化学反应速率:______________(用nA、tA、V表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 同温同压下,H2 (g) +Cl2(g) =2HCl (g)在光照和点燃条件下的△H不同
C. 保持其它条件不变,增加反应物的量或增大压强,反应速率就会随之改变
D. 使用催化剂会加快反应速率是因为催化剂降低了反应物的活化能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com