
【题目】(1)已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H=______kJmol-1.
(2)一定条件下,将NO2与SO2以物质的量比为1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。[不考虑N2O4(g)![]() 2NO2(g)的转化]
2NO2(g)的转化]
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2物质的量比为1:6,则平衡时SO2的转化率为___________。
【答案】 -41.8 kJmol-1 b 40%
【解析】试题分析: (1)根据盖斯定律,NO2(g)+SO2(g)SO3(g)+NO(g)的焓变;(2)根据化学平衡平衡的定义判断状态;(3)根据“三段式”计算,平衡时SO2的转化率。
解析:(1)Ⅰ、 2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1;
Ⅱ、2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,根据盖斯定律Ⅰ÷2-Ⅱ÷2得NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8 kJmol-1;
(2)a.反应前后气体物质的量不变,所以体系压强保持不变,不一定平衡,故a错误; b.NO2是红棕色气体,混合气体颜色保持不变,说明NO2浓度不变,反应一定平衡,故b正确;c.SO3和NO是的生成物,SO3和NO的体积比是定值,SO3和NO的体积比保持不变不一定平衡,故c错误; d.每消耗1molSO3的同时生成1molNO2,都是逆反应方向,不一定平衡,故d错误;
(3)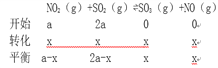
![]()
![]() , 平衡时SO2的转化率为
, 平衡时SO2的转化率为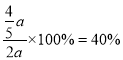 。
。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A. 该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B. 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A—)>c(HA)>c(Na+)>c(H+)>c(OH—)
C. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中2c(H+)+ c(HA) = c(A—) + 2c(OH—)
D. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中c(A—) + c(HA) = c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl-、NO3-、Ca2+ B.H+、Na+、SO42-、CO32-
C.Cu2+、K+、Cl--、OH- D.Ca2+、Na+、CO32、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
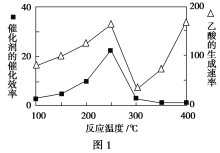
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
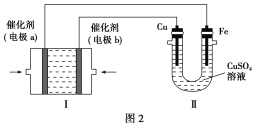
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com