
| V |
| Vm |
| m |
| n |
| V |
| Vm |
| 0.336L |
| 22.4L/mol |
| m |
| n |
| 1.065g |
| 0.015g/mol |
| 2g |
| 40g/mol |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、铊是质软的银白色的金属 |
| B、氢氧化铊是两性氢氧化物 |
| C、铊能置换出盐酸中的氢 |
| D、铊能与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
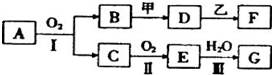
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 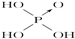 | 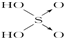 | 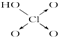 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) |
| C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) |
| D、c(OH-)=c(H+)+c(HS-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com