
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
 、
、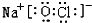 ,
, 或
或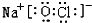 .
.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
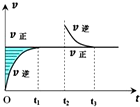 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系:
元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定开始时,溶液的PH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃 |
| B、纸层析法分离铁离子和铜离子实验中,点样后的滤纸晾干后将其末端浸入展开剂中约0.5cm |
| C、Cu2+与足量氨水反应的离子方程式 Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
| D、硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com