
| m |
| M |
| n |
| V |
| m |
| M |
| 40g |
| 40g/mol |
| n |
| V |
| 1mol |
| 0.25L |
| n |
| V |
| 0.2mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、同体积、同密度的CO和CO2气体 |
| B、同温度、同体积的O2和O3气体 |
| C、同压强、同体积的N2O和CO2气体 |
| D、同质量、不同密度的O2和O3 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 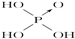 | 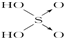 | 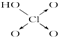 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
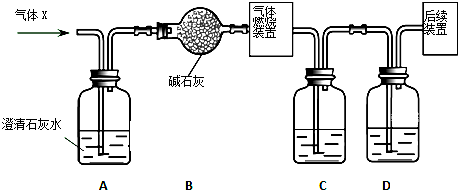
查看答案和解析>>
科目:高中化学 来源: 题型:
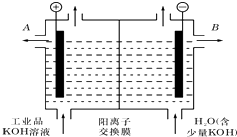 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
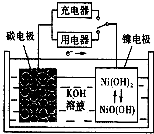 用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A、放电时,负极的电极反应为:H2-2e-+2OH-=2H2O |
| B、充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com