
| 10-13 |
| 10-11 |
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| 10-13 |
| 10-11 |
| 0.1b-0.01a |
| a+b |


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A、分子组成相差一个或若干个CH2的有机物互称为同系物 |
| B、分子式相同而结构不同的有机物必定是同分异构体 |
| C、若A与B互为同系物,则A、B必符合同一个通式 |
| D、同系物之间不可能是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、34 g H2O2中含有的阴离子数为NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、1mol重甲基(-CD3)含有电子数为9NA |
| D、1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
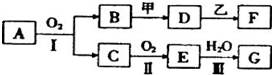
查看答案和解析>>
科目:高中化学 来源: 题型:
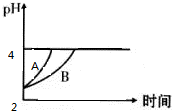 化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题:
化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题:| CO | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 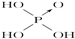 | 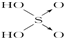 | 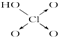 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
 )在催化剂作用下发生缩聚反应生成聚乳酸:
)在催化剂作用下发生缩聚反应生成聚乳酸:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com