
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液
D.将水加热到100°C,使pH=6
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
某有机物的结构简式为: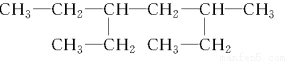 。下列说法不正确的是( )
。下列说法不正确的是( )
A.该有机物属于饱和烷烃
B.该烃的名称是3?甲基?5?乙基庚烷
C.该烃与2,5?二甲基?3?乙基己烷互为同系物
D.该烃的一氯取代产物共有8种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
A.c(CO32—)的大小关系为:②>⑤>③>④>①
B.c(HCO3—)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
25℃时,水中存在电离平衡:H2O H++OH-。下列关于水的说法,不正确的是 ( )
H++OH-。下列关于水的说法,不正确的是 ( )
A.水的电离是吸热过程
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.含H+的溶液显酸性,含OH-的溶液显碱性
D.水是极弱的电解质,在50℃时水的pH小于7
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
A.氯气 B.二氧化硫 C.醋酸钠 D.氯化钾
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
在一密闭恒容的容器中,可逆反应3A(g) 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
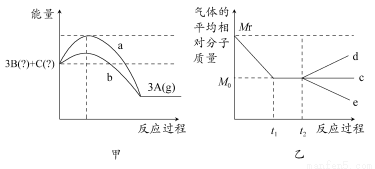
(1)由图甲可以判断3A(g) 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
(2)由图乙可以得出有关B和C状态的结论是________。
①若t2时刻升高温度,气体的平均相对分子质量变化一定符合________线(填“c”“d”或“e”)。
②若改变压强,气体的平均相对分子质量变化一定符合c线,则C物质的状态为________。
(3)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是________状态,C是________状态。
(4)如果B为气体,C为固体,取0.3 mol A恒温下在1 L容器中充分反应,平衡时测得B的浓度为0.21 mol/L。若使反应从逆反应开始,起始时在容器中加入0.3 mol B,同样条件下,要使平衡时B的浓度仍为0.21 mol/L,则C的物质的量的取值范围应该是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
一定温度下, 在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
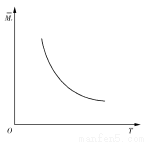
A.温度升高,平衡常数K减小
B.化学计量数a为1
C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2
D.X的转化率α=Q1/Q
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:填空题
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
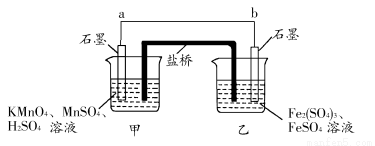
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com