
【题目】某结晶水合物的化学式为 RnH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中不正确的是( )
A.该溶液中溶质的质量分数为 w=![]()
B.该溶液的物质的量浓度为 c=![]()
C.25 ℃时 R 的溶解度为 S= ![]() g
g
D.该溶液的密度为 ρ=![]() g/mL
g/mL
【答案】A
【解析】
R·nH2O的相对分子质量为M,则R的相对分子质量为(M-18n);将ag该晶体溶于bg水中,溶液中R的物质的量为n(R)= n(R·nH2O)=![]() mol,溶液中的溶质为R;据此进行分析。
mol,溶液中的溶质为R;据此进行分析。
R·nH2O的相对分子质量为M,则R的相对分子质量为(M-18n);将ag该晶体溶于bg水中,溶液中R的物质的量为n(R)= n(R·nH2O)=![]() mol,溶液中的溶质为R;
mol,溶液中的溶质为R;
A项,溶液的质量为(a+b)g,溶质的质量为:![]() g,所以该溶液中溶质的质量分数为 w=
g,所以该溶液中溶质的质量分数为 w=![]() ,故A错误;
,故A错误;
B.溶质的物质的量为![]() mol,溶液的物质的量浓度c=
mol,溶液的物质的量浓度c=![]() ,故B正确;
,故B正确;
C.溶质的质量为![]() g,溶剂的质量(
g,溶剂的质量(![]() +b)g,根据S:100g=
+b)g,根据S:100g=![]() g:(
g:(![]() +b)g,解得溶解度S=
+b)g,解得溶解度S= ![]() g,故C正确;
g,故C正确;
D. 溶液的质量为(a+b)g,溶液的密度为: ρ=![]() g/mL,故D正确;
g/mL,故D正确;
故答案选A。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)___c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___(填字母)。
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)=c(HS—)+2c(S2—)
C. c(Na+)> c(HS—)+c(S2—)+ c(H2S)
D. c(H2S)> c(S2—)
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___,原因是___(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol MnO2和100 mL 12 mol·L-1盐酸混合后缓缓加热,生成气体单质A,反应完全后向留下的溶液中加入足量AgNO3溶液 (不考虑盐酸的挥发) 。下列说法错误的是
A.在生成气体A的反应中,MnO2是氧化剂,盐酸是还原剂
B.气体单质A是氯气,它的体积是2.24L
C.生成AgCl沉淀的物质的量为1mol
D.整个反应过程被氧化的盐酸有0.4mol,并转移了0.2mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加徳罗常数的值,诺贝尔物理学奖获得者让·佩兰于 1909 年提出常数命名 为阿伏加德罗常量来纪念他,下列说法正确的是
①标准状况下,11.2 L 以任意比例混合的氮气和氧气所含的原子数为 NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③2 mol/L 的氯化镁溶液中含氯离子数目为 4 NA
④标准状况下,22.4 L 水中分子数为 NA
⑤46 g NO2 和 N2O4 混合气体中含有原子数为 3 NA
A.①②⑤B.①②C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)气体发生装置B产生的气体是________。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入________(选填一个序号)试剂,实验现象是_______________________________。
b.若SO2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,实验现象是________________________________________。
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
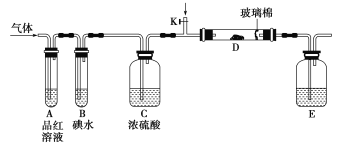
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为________________________________。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
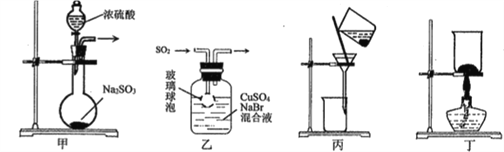
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
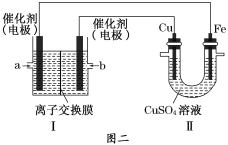
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
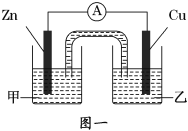
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了。原因是(用离子方程式和简要文字说明表示)___________________________,最后,他向烧杯中加入了一定量的_________________溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行了以下实验探究。
①图一是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是______溶液,Cu极的电极反应式是____________________。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为NaOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则Fe电极为__________(填“阳极”或“阴极”)。若铜电极的质量减轻3.2 g,则消耗的CH4在标准状况下的体积为___________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com