
在相同状况下,有关H2、O2、CH4三种气体的叙述正确的是( )
A.其密度之比等于对应的物质的量之比
B.其质量之比等于相对分子质量之比
C.等质量的三种气体,其体积比等于相对分子质量的倒数之比
D.等体积的三种气体,其物质的量比等于相对分子质量之比
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L FeCl3溶液中Cl﹣物质的量浓度相等是( )
|
| A. | 100mL 1mol/L NaCl溶液 | B. | 75mL 1mol/L MgCl2溶液 |
|
| C. | 150mL 3mol/L KCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是:( )
A.某离子M层上和L层上的电子数均为K层的4倍
B.Cl-的结构示意图: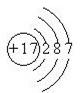
C.某物质的焰色反应为黄色,某物质一定为钠的化合物
D.14C和14N的质量数相等,互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
B.100 mL 1 mol·L-1 K2SO4溶液 中含有的钾离子数为0.1NA
中含有的钾离子数为0.1NA
C.10克氖气所含原子数约为6.02×1023
D.常温常压下,NA个H2分子的体积小于22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是__________________________________________。
(2)方案二:按如图所示装置进行实验。并回答以下问题:
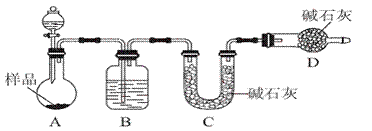
①实验前应先______________________________________________。
分液漏斗中应该装________(填“盐酸”或“稀硫酸”)。D装置的作用是_____________________________________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_________________________;
②实验中判断沉淀是否完全的方法是_________________________________________;
③若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品 中碳酸钠的质量分数为 (保留一位小数)。
中碳酸钠的质量分数为 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 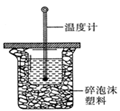 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越
越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
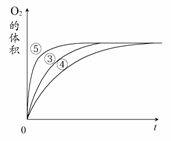
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com