
【题目】在密闭容中发生下列反应aA(g)cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大
B.平衡向正反应方向移动
C.D的体积分数变大
D.a<c+d
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+ ![]() C(s)═
C(s)═ ![]() CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+ ![]() O2(g)═Fe2O3(s)的△H是( )
O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4 kJ/mol
B.﹣627.6 kJ/mol
C.﹣744.7 kJ/mol
D.﹣169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
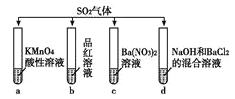
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏.下列有关有叙述中错误的是( )
是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏.下列有关有叙述中错误的是( )
A.![]() 的化学性质与
的化学性质与 ![]() 是相同
是相同
B.![]() 的原子序数为53
的原子序数为53
C.![]() 的原子核外电子数为78
的原子核外电子数为78
D.![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、CuO、MgSO4溶液、Ba(OH)2溶液、稀盐酸五种物质,在常温下两种物质间能发生的化学反应有
A. 6个 B. 5个 C. 4个 D. 3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: 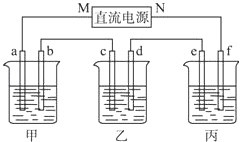
(1)电源的N端为极.
(2)电极b上发生的电极反应为 .
(3)列式计算电极b上生成的气体在标准状况下的体积 .
(4)电极c的质量变化是g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com