
【题目】下列图示中正确的实验操作是( )
A.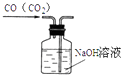
除去CO中的CO2
B.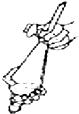
萃取时振荡混合液
C.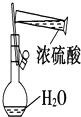
配制浓硫酸
D.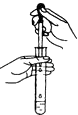
向试管中滴加液体
【答案】B
【解析】A.洗气装置中导气管遵循“长进短出”原则,否则易导致氢氧化钠溶液被排出而达不到实验目的,故A不符合题意;
B.左手握住活塞部分,右手食指顶住塞子,把分液漏斗倒转过来振荡,使两种液体充分混合,使溶质尽可能的被萃取,故B符合题意;
C.量筒只能量取溶液,不能作反应容器、不能配制溶液,如果稀释浓硫酸,应该将量筒紧贴烧杯口,把浓硫酸倒入烧杯中并不断搅拌,防止放出的热量使局部温度过高而溅出液体,故C不符合题意;
D.向试管中滴加溶液时,胶头滴管应该悬空,否则会污染胶头滴管,故D不符合题意;
故答案为:B.
A.洗气装置中的导气管应该长进短出;
B.根据萃取操作进行判断;
C.容量瓶不能作为容器使用;
D.用滴管向试管内加入试剂时,滴管不能伸入试管内.


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图: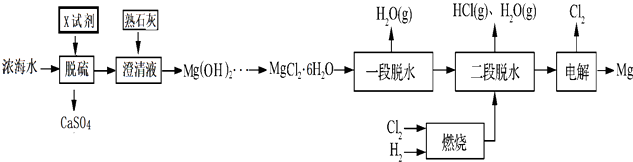
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 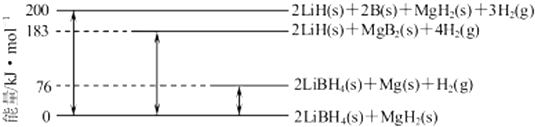
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol 的 ![]() 中,含有
中,含有 ![]() 个中子
个中子
B.pH=1的H3PO4溶液中,含有 ![]() 个
个 ![]()
C.2.24L(标准状况)苯在O2中完全燃烧,得到 ![]() 个CO2分子
个CO2分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加 ![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是(N﹣14 O﹣16 C﹣12 H﹣1)( )
A.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B.标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.1molCu在足量硫蒸气中反应时转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理: 
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式:。
②反应器中NH3还原CO2的化学方程式:。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 mg·L1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是。
(2)NSR(NOx储存还原)工作原理: NOx的储存和还原在不同时段交替进行,如图a所示。
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原。储存NOx的物质是。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:  □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L CH4②3.01×1023个HCl ③13.6g H2S ④0.2mol NH3四种气体,气体所占体积由小到大的顺序是(填序号,下同);所含氢原子数由小到大的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com