
����Ŀ��þ���仯������;�dz��㷺��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ���Ӻ�ˮ���Ƚ���ˮ������õ�ˮ��Ũ��ˮ��Ũ��ˮ����Ҫ�ɷ����£�
���� | Na+ | Mg2+ | Cl�� | SO42�� |
Ũ��/��gL��1�� | 63.7 | 28.8 | 144.6 | 46.4 |
������Ũ��ˮ��þ��һ�ι�����������ͼ��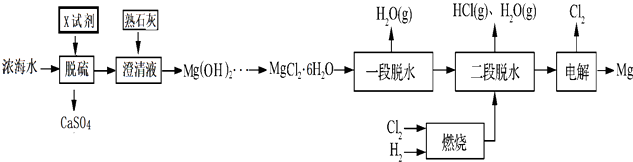
��ش���������
��1��Ũ��ˮ��Ҫ���е��������������ʵ���Ũ����С���� �� �����������У�����ѭ��ʹ�õ������� ��
��2���ڸù��չ����У�X�Լ��Ļ�ѧʽΪ ��
��3����һ����ˮ��Ŀ�����Ʊ�MgCl22H2O����������ˮ����Ŀ�����Ʊ����ԭ�ϣ�����MgCl26H2Oֱ�Ӽ�����ˮ���������Mg��OH��Cl�������ԭ���к���Mg��OH��Cl�����ʱMg��OH��Cl������������Mg��Ӧ��ʹ�����������MgO�ۻ�Ĥ�����͵��Ч�ʣ�����MgO�Ļ�ѧ����ʽΪ ��
��4�����Ƶ�Mg��OH��2�Ĺ�����Ũ��ˮ��������Ϊ80%����Mg��OH��2����������ˮ���Ƶõ��ԭ�ϵĹ�����þԪ�ص�������Ϊ90%����1m3Ũ��ˮ�ɵá�������ˮ����ĵ��ԭ������Ϊg��
��5����LiCl��KCl������Ϊ����ʵ�Mg��V2O5�����ս�������ij��õ�Դ���õ�ص��ܷ�ӦΪ��Mg+V2O5+2LiCl MgCl2+V2O4Li2O �õ�ص�������ӦʽΪ ��
��6��Mg�Ͻ�����Ҫ�Ĵ�����ϣ�2LiBH4/MgH2��ϵ�����ʱ�ʾ��ͼ���£��� Mg��s��+2B��s�� MgB2��s����H= �� 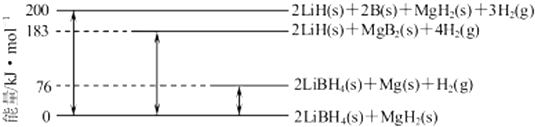
���𰸡�
��1��SO42����Cl2��HCl
��2��CaCl2
��3��2Mg��OH��Cl+Mg=MgCl2+2MgO+H2��
��4��82080
��5��V2O5+2Li++2e��=V2O4?Li2O
��6����93kJ/mol
���������⣺Ũ��ˮ�����Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ�������ʯ�ң�������������þ����������MgCl26H2O��һ����ˮ����MgCl22H2O����ͨ��HCl�ķ�Χ�м����Ȼ�þ��Һ�õ��Ȼ�þ�����ɵõ�þ����������1���ɱ�������c��Na+��= ![]() =2.77mol/L��c��Mg2+��=
=2.77mol/L��c��Mg2+��= ![]() =1.2mol/L��c��Cl����=
=1.2mol/L��c��Cl����= ![]() =4.07mol/L��c��SO42����=
=4.07mol/L��c��SO42����= ![]() =0.48mol/L����SO42�������ʵ���Ũ����С��������������������������Ӧ�����Ȼ��⣬�Ȼ������������þ��Ӧ�Ʊ��Ȼ�þ�����ѭ������Cl2��HCl�����Դ��ǣ�SO42����Cl2��HCl����2��XΪ�Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ����Դ��ǣ�CaCl2����3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO����Ӧ�Ļ�ѧ����ʽΪ2Mg��OH��Cl+Mg=MgCl2+2MgO+H2�������Դ��ǣ�2Mg��OH��Cl+Mg=MgCl2+2MgO+H2������4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��=
=0.48mol/L����SO42�������ʵ���Ũ����С��������������������������Ӧ�����Ȼ��⣬�Ȼ������������þ��Ӧ�Ʊ��Ȼ�þ�����ѭ������Cl2��HCl�����Դ��ǣ�SO42����Cl2��HCl����2��XΪ�Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ����Դ��ǣ�CaCl2����3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO����Ӧ�Ļ�ѧ����ʽΪ2Mg��OH��Cl+Mg=MgCl2+2MgO+H2�������Դ��ǣ�2Mg��OH��Cl+Mg=MgCl2+2MgO+H2������4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��= ![]() mol��������Mg��OH��2�����ʵ���Ϊ
mol��������Mg��OH��2�����ʵ���Ϊ ![]() mol��80%����������ˮ����MgCl2�����ʵ���Ϊ
mol��80%����������ˮ����MgCl2�����ʵ���Ϊ ![]() ��80%��90%������Ϊ
��80%��90%������Ϊ ![]() mol��80%��90%��95g/mol=82080g�����Դ��ǣ�82080����5������������ԭ��Ӧ��V2O5����ԭ����V2O4Li2O���缫����ʽΪV2O5+2Li++2e��=V2O4Li2O�����Դ��ǣ�V2O5+2Li++2e��=V2O4Li2O����6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJmol��1�� 2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJmol��1��
mol��80%��90%��95g/mol=82080g�����Դ��ǣ�82080����5������������ԭ��Ӧ��V2O5����ԭ����V2O4Li2O���缫����ʽΪV2O5+2Li++2e��=V2O4Li2O�����Դ��ǣ�V2O5+2Li++2e��=V2O4Li2O����6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJmol��1�� 2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJmol��1��
2LiBH4��s��+MgH2��s��=2LiH��s��+MgB2��s��+4H2��g����H=+183 kJmol��1��
2LiH��s��+MgB2��s��+4H2��g��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+��200��183��kJmol��1��
����MgB2��s��+H2��g��=2B��s��+MgH2��s����H=+17 kJmol��1��
���ԩ��ܩ��ڵã�Mg��s��+2B��s���TMgB2��s����H=����17+76��kJmol��1=��93kJmol��1 ��
���Դ��ǣ���93kJmol��1 ��
�����㾫�������ڱ��⿼��ķ�Ӧ�Ⱥ��ʱ䣬��Ҫ�˽��ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ��ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵõ���Ӧʵ����۵��� ( )
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2SO3 | KMnO4��Һ��ɫ | SO2��Ư���� | |
B | Ũ���� | KMnO4 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2 >Br2 | |
C | ϡ���� | ̼���� | CaCl2��Һ�����Ա仯 | CO2����CaCl2��Ӧ | |
D | Ũ���� | ���� | ��ˮ��ɫ | Ũ���������ˮ�ԡ���ˮ�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.1 mol OD�����Ӻ��е����ӡ���������Ϊ10NA
B.��״���£�4.48 L���麬�еķ�����Ϊ0.2NA
C.��״���£�6.72LNO2��ˮ��Ӧ���ĵ�������������Ϊ0.2NA
D.��ϩ�ͻ�������ɵ�42 g�����������ԭ�ӵĸ���Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס���������ϡ��Һ����ü�pH=a���ҵ�pH=a+1�������ƶ�����ȷ���ǣ� ��
A.���ʵ���Ũ��c���ף�=10c���ң�
B.������ˮ���������H+�����ʵ���Ũ�Ⱥ��ҵ����
C.�к͵����ʵ���Ũ�ȵ������NaOH��Һ��ס�����������V���ң���10V���ף�
D.���е�c��OH����Ϊ����c��OH������10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��������ͼװ�òⶨij���Ṥ���ŷ�β���ж�������ĺ�����ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ������ĵ�ˮ����ͨ��ʵ��ⶨSO2�ĺ�������ϴ��ƿC����Һ��ɫ�պ���ʧʱ�������رջ���A��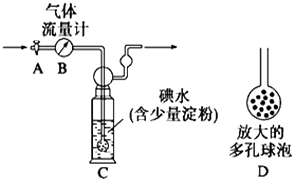
��1��C�е���ĩ������һ���������D���������� �� �������ʵ���ȷ�ȡ�
��2��C�з�����ӦΪSO2 + I2 +2H2O = H2SO4+ 2HI , I2 ��������������ԭ������
��3��ijͬѧ���ݷ�Ӧ��SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl�������һ��ʵ�飬�Ƚ�SO2��Fe2+ ��ԭ�Ե�ǿ��:ȡ����C����Һ���Թ��У��μ�2mL�Ȼ�����Һ��ҡ�ȣ����뼸��KSCN��Һ����Һ�����ɫ �����Լ���ѡ,�����Ʋ��衢����ͽ��ۣ���
��4���� ��������B�иպ�ͨ��2Lβ��ʱ��C����Һ��ɫ�պ���ʧ�������رջ���A������C��ǡ�õõ�100mL��Һ��������Һȫ��ת������ƿ�У��������BaCl2��Һ�����ˡ�ϴ�ӡ�����õ�4.66g ��ɫ������ͨ�������֪������β���ж�������ĺ���Ϊg/L�� �����ԭ������: Ba-137 S-32 O-16��
�� ��ϴ��ƿC����Һ��ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2����(�ƫ�ߡ�����ƫ�͡�����Ӱ�족).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��н�����ǽ����ķֽ紦�������ҵ�
A. �Ͻ�B. �뵼�����C. ����D. ũҩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18�֣�2-����-3-�ȱ����ᣨF������Ҫ��ҽҩ�м��壬���Ʊ�����ͼ���£� 
�ش��������⣺
��1��![]() �����в�ͬ��ѧ��������ԭ�ӹ����֣�����ԭ����Ŀ���Ϊ��
�����в�ͬ��ѧ��������ԭ�ӹ����֣�����ԭ����Ŀ���Ϊ��
��2��B������Ϊ��д��������������B������ͬ���칹��Ľṹ��ʽ�� a��������ֻ������ȡ�����һ�Ϊ��λ b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
��3��������δ���üױ�ֱ�������ķ����Ʊ�B�����Ǿ��ɢ٢ڢ�������Ӧ��ȡB����Ŀ������
��4��д���Ļ�ѧ��Ӧ����ʽ�� �� �ò���Ӧ����ҪĿ������
��5��д����ķ�Ӧ�Լ�����������F�к��������ŵ�����Ϊ��
��6���ڷ�����д����  Ϊ��Ҫԭ�ϣ������ٲ����Ʊ����ļ��ۺ�������̡�
Ϊ��Ҫԭ�ϣ������ٲ����Ʊ����ļ��ۺ�������̡�
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ����ȷ��ʵ������ǣ�������
A.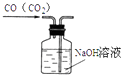
��ȥCO�е�CO2
B.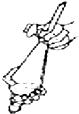
��ȡʱ���Һ
C.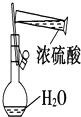
����Ũ����
D.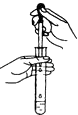
���Թ��еμ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]��15�֣� �غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A.404.4
B.553.5
C.589.2
D.670.8
E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ����� �� ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ������
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ �� ����ԭ�ӵ��ӻ�����Ϊ��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊnm����K���ڵ�O����Ϊ�� 
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����λ�ã�O����λ�á�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com