
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4molH—Cl键的同时生成4molH—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法不正确的是

A.CO2过量排放是导致温室效应的原因之一
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2-=CO32-
D.CO2最终转化为C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是________;
(2)X电极发生的电极反应式为____________________;银电极上发生的电极反应为________(填“氧化”或“还原”)反应。
(3)外电路中的电子________(填“流出”或“流向”)Ag电极。
(4)当有3.2 g铜溶解时,银电极增重________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
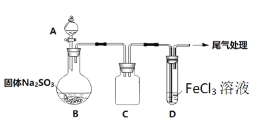
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下图所示,下列有关说法错误的是( )
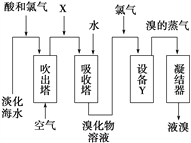
A. X为SO2气体,也可将SO2换成Na2SO3
B. 设备Y为蒸馏塔
C. 在提取溴的过程中一定有Br-被氧化
D. 工业上,每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
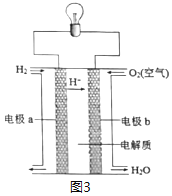
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com