
����Ŀ��N2H4(��)������ҩ��ԭ�ϣ�Ҳ���������ȼ�ϡ���֪�Ȼ�ѧ����ʽ��
��ӦI��N2H4(g)![]() N2(g)+2H2(g) ��H1>0��
N2(g)+2H2(g) ��H1>0��
��ӦII��N2(g)+3H2(g)![]() 2NH3(g) ��H2<0��
2NH3(g) ��H2<0��
��ӦIII��N2H4(g)+H2(g)![]() 2NH3(g) ��H��
2NH3(g) ��H��
�����ƶϲ���ȷ���ǣ� ��
A.N2H4���ѹ��ۼ���Ҫ��������
B.��ӦI��1molN2H4(g)������С��1molN2(g)��2molH2(g)��������
C.��ӦII������Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
D.��H=��H1+��H2
���𰸡�C
��������
A���ڻ�ѧ��Ӧ�У��Ͽ���ѧ������Ҫ������������N2H4���ѹ��ۼ���Ҫ����������A���������⣻
B�����ݷ�Ӧ��1molN2H4(g)�ֽ�����1molN2(g)��2molH2(g)����Ӧ���ȣ�˵��1molN2H4(g)��������С��1molN2(g)��2molH2(g)����������B���������⣻
C����Ӧ���Ƿ��ȷ�Ӧ��������H=����Ӧ���-�淴Ӧ��ܣ�������֪����Ӧ���С���淴Ӧ��ܣ�C�������⣻
D����Ӧ��=��Ӧ��Ӧ���ݸ�˹���ɣ�����H=��H1+��H2��D���������⡣
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������Ԥ����ȷ����
A | B | C | D |
|
|
|
|
�ձ��в�����ɫ������һ��ʱ�����������Ա仯 | ��������ְ�ɫ���ǣ����ȱ���� | KMnO4 ������Һ�ڱ��ͼױ��о���ɫ | Һ��ֲ㣬�²�� ��ɫ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.1000 mol��L��1 NH3��H2O��Һ����εμ�0.1000 mol��L��1 HCl��Һ����ҺpH�����HCl��Һ����ı仯������ͼ��ʾ������˵����ȷ����
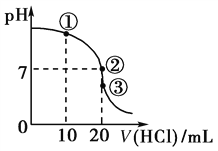
A. ����Һ��c(Cl��)>c(NH)>c(OH��)>c(H��)
B. ����Һ��c(NH)��c(Cl��)>c(OH��)��c(H��)
C. ����������������ʾ����Һ��ˮ�ĵ���̶Ȣ�>��>��
D. �ζ������в����ܳ��֣�c(NH3��H2O)>c(NH)>c(OH��)>c(Cl��)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⡣���պϸ�װ�õĿ���ʱ���۲쵽��������ָ�뷢����ƫת��
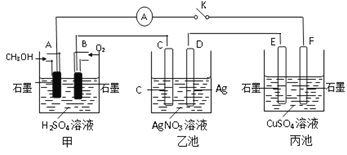
��ش��������⣺
(1)�׳�Ϊ_____(�ԭ��ء������ء���Ƴء�)��ͨ��CH3OH�缫�ĵ缫��ӦʽΪ_________________________��
(2)�ҳ���C(ʯī)�缫������Ϊ____(�������������������������������)���ܷ�Ӧ�Ļ�ѧ����ʽΪ_________________________��
(3)���ҳ���D����������5.4gʱ���׳�������������O2�����Ϊ_____mL(��״��)��ת�Ƶĵ�����Ϊ__________
(4)������_____(�E����F��)������ͭ��
(5)�����е缫���䣬������Һ����NaCl��Һ�����رպ�һ��ʱ�������Һ��pH��_____(�������С�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.Ǧ���طŵ�ʱ�������������ᣬ��������
B.����CH3COONa��Һ���¶ȣ���ˮ�����ӻ�������pH������
C.CH3CH=CHCH3�����е��ĸ�̼ԭ�Ӷ���һ��ֱ����
D.������Ksp(AgBr)=5.0��10-13��Ksp(AgCl)=1.8��10-10����S(AgBr)>S(AgCl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�����������Ӧ���������ܴ���������ǣ� ��
A.��ˮ���������c(H+)=1��10-10molL-1����Һ�У�NO3-��Fe2+��Na+��SO42-
B.![]() =10-10molL-1����Һ�У�NH4+��I-��Cl-��K+
=10-10molL-1����Һ�У�NH4+��I-��Cl-��K+
C.![]() =1��106����Һ�У�K+��Na+��Cl-��HCO3-
=1��106����Һ�У�K+��Na+��Cl-��HCO3-
D.���Ե缫���AgNO3�����Һ�У�SO32-��K+��Na+��S2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������ѭ��Ч�ʺ��ȶ��ԣ���ѧ�ҽ���������ά�����״Zn��3D-Zn�����Ը�Ч����ZnO���ص㣬����˲���ǿ���Ե���ʵ�3D-Zn-NiOOH���ε�أ��ṹ��ͼ��ʾ����ط�ӦΪZn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)������˵��������ǣ� ��
ZnO(s)+2Ni(OH)2(s)������˵��������ǣ� ��
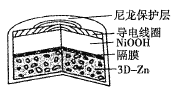
A.��ά�����״Zn���нϸߵı��������������ZnO��ɢ�ȸ�
B.�ŵ�ʱ������ӦΪNiOOH(s)+H2O(l)+e-=Ni(OH)2(s)+OH-(aq)
C.�ŵ�ʱ������ӦΪZn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)
D.�ŵ������OH-ͨ����Ĥ�Ӹ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.ˮ��ͭ���ӵ�ģ����ͼ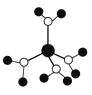 �������д��ڼ��Թ��ۼ�����λ�������Ӽ�
�������д��ڼ��Թ��ۼ�����λ�������Ӽ�
B.CaF2����ľ�����ͼ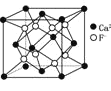 ������F-�����Ca2+�����������
������F-�����Ca2+�����������
C.��ԭ�ӵĵ�����ͼ��ͼ ����ԭ�Ӻ�������������ԭ�Ӻ˸����˶�
����ԭ�Ӻ�������������ԭ�Ӻ˸����˶�
D.����Cu��Cuԭ�Ӷѻ�ģ����ͼ ��Ϊ�����������ܶѻ���Cuԭ�ӵ���λ����Ϊ12�������ռ�������68%
��Ϊ�����������ܶѻ���Cuԭ�ӵ���λ����Ϊ12�������ռ�������68%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com