
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学,为测定某含铜3%~5%的铝铜合金(不含其它元素)中铜的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___。
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥___mL。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铜的质量分数将__(填“偏高”、“偏低”或“无影响”)。
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因___。
(4)实验结束时 ,生成氢气的体积近似等于___。
(5)锥形瓶中残存的氢气对实验结果是否有影响___(填“有”“没有”或“不能判断”)
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。
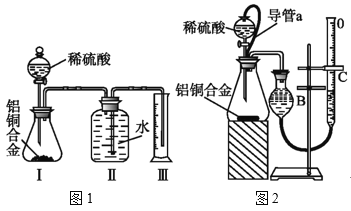
①装置中导管a的作用是___。
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
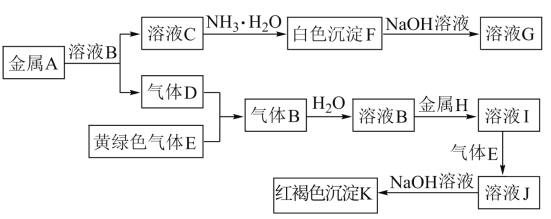
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
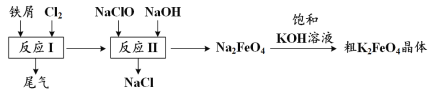
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

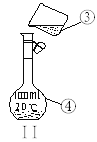
(1)写出下列仪器的名称:
①___________;②__________;④___________;
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为;_________。冷凝管中的水流从______进______出(填字母代号)。
(3)现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常状况下,A为固态单质。根据如图所示转化关系,回答:
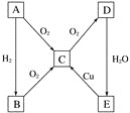
(1)写出A、C、E的化学式:
A.__________,C.__________,E.__________。
(2)写出下列反应的化学方程式:
①E→C___________________________________。
②C→D_________________________。
(3)B与E的浓溶液__________(填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为___,反应现象为_________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因:__,并写出有关的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
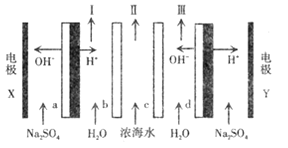
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com