
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
【答案】SO2、H2SO3、Na2SO3 1∶2 将Y通入品红溶液中,品红溶液褪色,加热后又变红色 ![]() b +3
b +3
【解析】
(1)处于元素高价态的微粒只具有氧化性,处于低价态只具有还原性,而处于中间价态的微粒具有氧化性和还原性;
(2)硫化氢具有还原性,二氧化硫既有氧化性又有还原性,硫化氢和二氧化硫发生氧化还原反应生成硫和水;
(3)SO2具有漂白性,能与有色物质生成不稳定的无色物质;
(4)浓硫酸与铜共热发生氧化还原反应生成硫酸铜、二氧化硫和水;
(5)Na2S2O3中S元素的化合价为+2价,若要用归中反应制备Na2S2O3,反应物中S元素的化合价必须有1个大于+2,有1个小于+2;
(6)由得失电子数目守恒计算可得。
(1)处于元素高价态的微粒只具有氧化性,处于低价态只具有还原性,而处于中间价态的微粒具有氧化性和还原性,由题给图示可知,硫元素处于中间价态的化合物有+4价的SO2、H2SO3、Na2SO3;
(2)硫化氢具有还原性,二氧化硫既有氧化性又有还原性,硫化氢和二氧化硫发生氧化还原反应生成硫和水,反应的化学方程式为2H2S+ SO2=3S+2H2O,由方程式可知氧化剂SO2与还原剂H2S的物质的量之比为1:2;
(3)SO2具有漂白性,能与有色物质生成不稳定的无色物质,则检验SO2的方法为将SO2通入品红溶液中,使品红溶液褪色,加热后又变红色;
(4)浓硫酸与铜共热发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的化学方程式为![]() ;
;
(5)Na2S2O3中S元素的化合价为+2价,若要用归中反应制备Na2S2O3,反应物中S元素的化合价必须有1个大于+2,有1个小于+2,a中两种物质中S元素化合价均小于+2,c、d中两种物质中S元素化合价均大于+2,只有b中S元素化合价1个大于+2,1个小于+2,故选b;
(6)设Cr元素在还原产物中的化合价为+a,由得失电子数目守恒可得24×10-3L×0.05 molL-1×2=20×10-3L ×0.02 mol·L-1×2×(6—a),解得a=3。


科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是
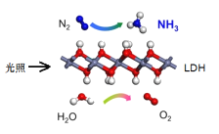
A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为Zn-Cu原电池的示意图,请回答:
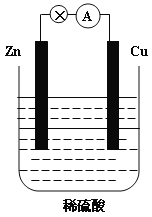
(1)锌片为原电池的______________(填“正”或“负”)极,该极的电极反应式是___________。该反应属于_______________(填“氧化”或“还原”)反应。
(2)__________(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________(填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________(填“增大”或“减小”,下同),烧杯中溶液的质量__________。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
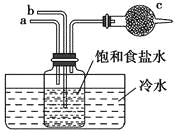
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
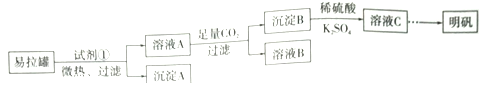
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
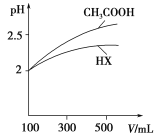
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com