
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
【答案】Fe、Ni N>O>C 第四周期第Ⅷ族 4 1s22s22p63s23p63d104s1 共价 水和氨气分子间能形成氢键、水和氨气分子都是极性分子 三角锥型 sp3
【解析】
根据元素周期表结构可知,①~⑩号元素分别为氢元素、碳元素、氮元素、氧元素、钠元素、磷元素、硫元素、铁元素、镍元素、铜元素;
(1)d区包括ⅢB族~ⅥIB族、第ⅥII族;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,N元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的;
(3)⑧为铁元素,原子序数为26,结合图示判断在周期表中位置;⑩为Cu,原子序数为29,结合构造原理书写核外电子排布式;根据两种元素电负性差值大于1.7时为离子化合物,小于1.7时为共价化合物的经验规则可以判断;
(4)③号元素原子与①号元素原子形成的原子个数比为1:3的分子X为氨气,氨气为三角锥形;①与④形成的化合物Y为水,结合水和氨气分子间能形成氢键和相似相溶原理分析;
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子为SO32-,根据价层电子对分析空间构型、中心原子的杂化类型。
①~⑩号元素分别为氢元素、碳元素、氮元素、氧元素、钠元素、磷元素、硫元素、铁元素、镍元素、铜元素;
(1)d区包括ⅢB族~ⅥIB族、第ⅥII族,则上述元素中属于d区的元素有Fe和Ni;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能N>O,则第一电离能大小顺序为:N>O>C;
(3)⑧号元素为Fe,根据元素周期表结构可知,Fe位于第四周期第Ⅷ族,核电荷数为26,其电子排布式为1s22s22p63s23p63d64s2,价电子排布图为![]() ,则原子核外未成对电子数为4;⑩为Cu,原子序数为29,其核外电子排布式为1s22s22p63s23p63d104s1;已知元素⑩和⑦的电负性分别为1.9和2.5,二者电负性之差为0.6<1.7,则⑩与⑦形成的化合物属于共价化合物;
,则原子核外未成对电子数为4;⑩为Cu,原子序数为29,其核外电子排布式为1s22s22p63s23p63d104s1;已知元素⑩和⑦的电负性分别为1.9和2.5,二者电负性之差为0.6<1.7,则⑩与⑦形成的化合物属于共价化合物;
(4)③号元素原子与①号元素原子形成的原子个数比为1:3的分子X为氨气,氨气为极性分子;①与④形成的化合物Y为水,由于水和氨气分子间能形成氢键、水和氨气分子都是极性分子,所以氨气在水中的溶解度很大;
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子为SO32-,中心原子价层电子对数为3+![]() =4,其中有1个孤电子对,则空间构型为三角锥型,杂化类型是sp3。
=4,其中有1个孤电子对,则空间构型为三角锥型,杂化类型是sp3。


科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

请回答下列问题。
(1)滤渣Ⅰ的主要成分是___(填化学式)。
(2)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是___、___、过滤、洗涤、干燥。
(3)还原时,试剂X若选用SO2,则该反应的离子方程式为___。
(4)绿矾(FeSO4·7H2O)若保存不当或长期放置,易与空气中的氧气反应,检验绿矾是否被氧化的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

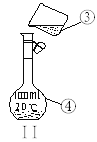
(1)写出下列仪器的名称:
①___________;②__________;④___________;
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为;_________。冷凝管中的水流从______进______出(填字母代号)。
(3)现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
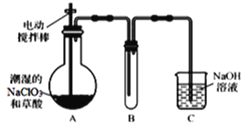
(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是________。
(2)装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常状况下,A为固态单质。根据如图所示转化关系,回答:
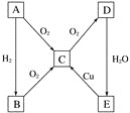
(1)写出A、C、E的化学式:
A.__________,C.__________,E.__________。
(2)写出下列反应的化学方程式:
①E→C___________________________________。
②C→D_________________________。
(3)B与E的浓溶液__________(填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为___,反应现象为_________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因:__,并写出有关的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明可用于降低血糖中的胆固醇.其结构简式为: 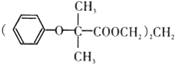
该物质的合成路线如图所示:
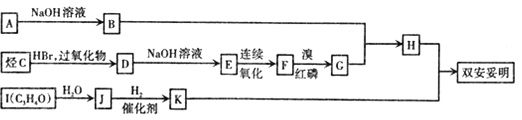
已知:I. 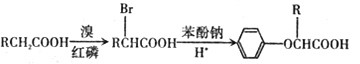
II.RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
III.C的密度是同温同压下氢气密度的28 倍.且支链有一个甲基;I 能发生银镜反应且1 molI能与 2molH2 发生加成反应;K 的结构具有对称性。
请回答下列问题:
(1)A的结构简式为 ___________,J中所含官能团名称为_________。
(2)D的名称为__________ 。
(3)反应D→E的化学方程式为 ___________,其反应类型是__________。
(4)“H+K→双安妥明”的化学方程式为 ___________。
(5)L为比H的相对分子质量小14的同系物.其中满足①苯环上有两个取代基,② 苯环上一氯代物只有两种,③能与FeCl3溶液发生显色反应.且属于酯的L有_______种 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com