
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
【答案】D
【解析】
①由于乙反应的两边气体的系数和相同且都是气体,平均相对分子质量始终不变,所以平均相对分子质量不再不变,无法判断乙反应是否达到平衡状态,故不选①;
②乙反应的两边气体的系数和相同,反应中压强始终不变,所以压强不变无法判断乙是否达到平衡状态,故不选②;
③各气体组分浓度相等,不能判断各组分的浓度不变,无法证明反应达到了平衡状态,故不选③;
④由于乙反应的两边都是气体,容器的容积不变,密度始终不变,所以混合气体的密度保持不变,无法判断乙是否达到平衡状态,故不选④;
⑤单位时间内,消耗水质量与生成氢气质量比为9∶1,水与氢气的物质的量之比为1∶1,表示的都是正反应速率,无法判断正逆反应速率相等,故不选⑤;
⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量,说明正逆反应速率相等,能说明达到了平衡状态,故选⑥;
答案选D。


科目:高中化学 来源: 题型:
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
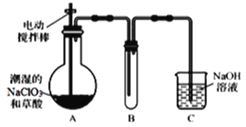
(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是________。
(2)装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,则下列说法不正确的是
A. 23g 钠在空气中充分燃烧,转移的电子数为NA
B. 50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA
C. 0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA
D. 常温常压下,8.8gN2O 和CO2混合气体所含的原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-ykJ·mol-1
CO2(g)+H2(g) ΔH2=-ykJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
(1)2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
(2)下列有关合成二甲醚的说法正确的是___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,
CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将___(选填“增大”“减小”或“不变”)。
将___(选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比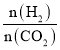 的关系如图所示。
的关系如图所示。
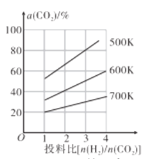
①500K时,将9molH2和3molCO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是___(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
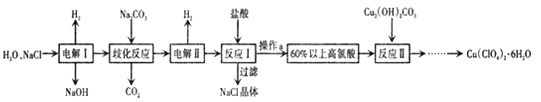
回答下列问题
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
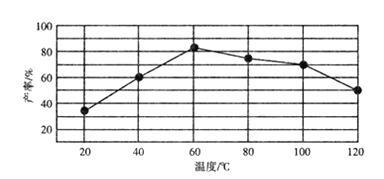
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在冶金工业中,常以C作为还原剂,如温度高于980 K时,氧化产物以CO为主,低于980 K时以CO2为主。
(1)已知2CO(g)![]() CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
(2)电子工业中清洗硅片上的SiO2(s)的反应为:
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1。
设ΔH和ΔS不随温度变化而变化,则此反应自发进行的温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com