
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
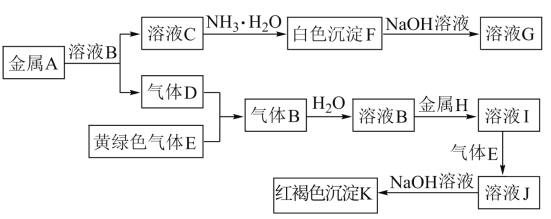
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常状况下,A为固态单质。根据如图所示转化关系,回答:
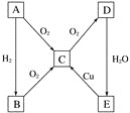
(1)写出A、C、E的化学式:
A.__________,C.__________,E.__________。
(2)写出下列反应的化学方程式:
①E→C___________________________________。
②C→D_________________________。
(3)B与E的浓溶液__________(填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为___,反应现象为_________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因:__,并写出有关的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
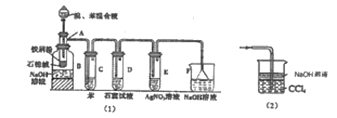
A.苯和液溴在A中发生反应的化学方程式为:![]() +Br2
+Br2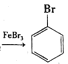 +HBr
+HBr
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
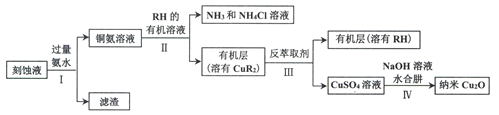
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A. 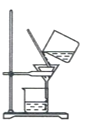 B.
B. 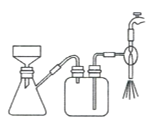 C.
C. 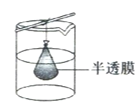
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
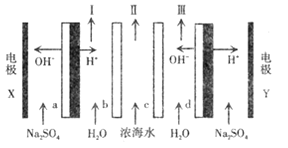
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=____kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
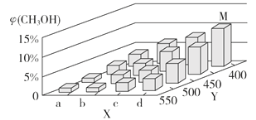
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点____ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_________________。
(3)工业上可采用CH3OH CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
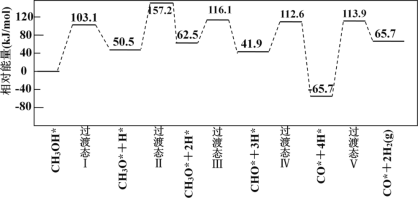
该历程中,放热最多的步骤的化学方程式为________。
(4)PbI2与金属锂以LiI-Al2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb,则b极上的电极反应式为:_____。

(5)CH3NH2的电离方程式为CH3NH2+H2O![]() CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com