
����Ŀ����֪25 ��ʱ����������ʵĵ���ƽ�ⳣ���������±���
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��101 | 1.7��105 | 6.2��1010 | K1=4.3��107 K2=5.6��1011 |
�ش��������⣺
��1��д��̼��ĵ�һ������ƽ�ⳣ������ʽ��K1=_______________________��
��2�������ʵ���Ũ�ȵ�a.CH3COONa��b.NaCN��c.Na2CO3��d.NaHCO3��Һ��pH�ɴ�С��˳��Ϊ________(����ĸ)��
��3�������£�0.1 mol��L1��CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����________(�����)
A��[H��] B��[H��]/[CH3COOH]
C��[H��]��[OH] D��[OH]/[H��]
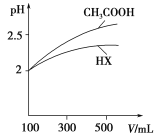
��4�������Ϊ100 mL pH=2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��________(����ڡ�����С�ڡ����ڡ�)CH3COOH�ĵ���ƽ�ⳣ����
��5��д������CO2ͨ�����������Һ�е����ӷ���ʽ��_____________________________��
���𰸡�![]() cbdaBDС��CO2��H2O��ClO===HCO3-��HClO
cbdaBD��CO2��H2O��ClO===HCO3-��HClO
��������
��1��̼��ĵ�һ�����뷽��ʽ��![]() �����ݵ��뷽��ʽ��д����ƽ�ⳣ������ʽ����2���������ƽ�ⳣ��ԽС���������ˮ��̶�Խ��ˮ��̶ȣ�CO32-��CN-��HCO3-��CH3COO-��ˮ����Լ��ԣ�ˮ��̶�Խ����Խǿ����3��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С��c(CH3COO-)��С�� Kw������c(OH-)��������4����ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȱȴ���С����HX�ȴ����������������ƽ�ⳣ��С����5������HCO3-��HClO��H2CO3������CO2ͨ�����������Һ������̼�����ƺʹ����ᡣ
�����ݵ��뷽��ʽ��д����ƽ�ⳣ������ʽ����2���������ƽ�ⳣ��ԽС���������ˮ��̶�Խ��ˮ��̶ȣ�CO32-��CN-��HCO3-��CH3COO-��ˮ����Լ��ԣ�ˮ��̶�Խ����Խǿ����3��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С��c(CH3COO-)��С�� Kw������c(OH-)��������4����ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȱȴ���С����HX�ȴ����������������ƽ�ⳣ��С����5������HCO3-��HClO��H2CO3������CO2ͨ�����������Һ������̼�����ƺʹ����ᡣ
��1��̼��ĵ�һ�����뷽��ʽ��![]() ��̼��ĵ�һ������ƽ�ⳣ������ʽ��K1=
��̼��ĵ�һ������ƽ�ⳣ������ʽ��K1=![]() ����2���������ƽ�ⳣ��ԽС���������ˮ��̶�Խ��ˮ��̶ȣ�CO32-��CN-��HCO3-��CH3COO-��ˮ����Լ��ԣ�ˮ��̶�Խ����Խǿ������pH�ɴ�С��˳��ΪNa2CO3>NaCN>NaHCO3>CH3COONa����3��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c��H+����С������ƽ�ⳣ��
����2���������ƽ�ⳣ��ԽС���������ˮ��̶�Խ��ˮ��̶ȣ�CO32-��CN-��HCO3-��CH3COO-��ˮ����Լ��ԣ�ˮ��̶�Խ����Խǿ������pH�ɴ�С��˳��ΪNa2CO3>NaCN>NaHCO3>CH3COONa����3��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c��H+����С������ƽ�ⳣ��![]() ��c��CH3COO-����С������[H��]/[CH3COOH]������ Kw���䣬c(H+)��С������c(OH-)����[OH]/[H��]��������ѡBD����4����ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȱȴ���С����HX�ȴ����������������ƽ�ⳣ��С�ڴ����5������HCO3-��HClO��H2CO3������CO2ͨ�����������Һ������̼�����ƺʹ����ᣬ���ӷ���ʽ��CO2��H2O��ClO = HCO3-��HClO��
��c��CH3COO-����С������[H��]/[CH3COOH]������ Kw���䣬c(H+)��С������c(OH-)����[OH]/[H��]��������ѡBD����4����ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȱȴ���С����HX�ȴ����������������ƽ�ⳣ��С�ڴ����5������HCO3-��HClO��H2CO3������CO2ͨ�����������Һ������̼�����ƺʹ����ᣬ���ӷ���ʽ��CO2��H2O��ClO = HCO3-��HClO��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�صĻ��ϼ��Ʋ����ʵ������ǻ�ѧ�о�����Ҫ�ֶΡ���ͼ����Ԫ�صij������ϼ��벿���������Ķ�Ӧ��ϵ��

(1)����Ԫ�ػ��ϼ۱仯�ĽǶȷ�����ͼ�м������������л�ԭ�ԵĻ�������_______________(�ѧʽ)��
(2)��X��Y��ϣ������ɵ���ɫ���塣�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_____________��
(3)��������Y�ķ�����______________________________��
(4)Z��Ũ��Һ��ͭ������һ�������¿��Է�����ѧ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
(5)Na2S2O3����Ҫ�Ļ���ԭ�ϣ���������ԭ��Ӧ�ĽǶȷ����������Ʊ�Na2S2O3�ķ��������Ͽ��е���_____________(����ĸ)��
a��Na2S��S b��Na2SO3��S
c��SO2��Na2SO4 d��Na2SO3��Na2SO4
(6)��֪Na2SO3�ܱ�K2Cr2O7����ΪNa2SO4����24mL 0.05mol��L-1��Na2SO3��Һ�� 20mL 0.02mol��L-1��K2Cr2O7��Һǡ�÷�Ӧʱ��CrԪ���ڻ�ԭ�����еĻ��ϼ�Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���Ե�·���ʴҺ�����д���Cu2+��Fe2+��Fe3+��Ϊԭ���Ʊ�����Cu20���Ʊ��������£�
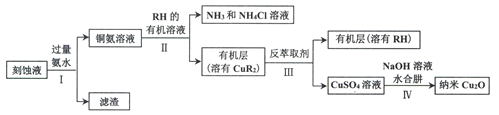
��֪����Cu2O�ڳ�ʪ�Ŀ����л�������������CuO��Ҳ�ױ���ԭΪCu; Cu2O������ˮ���������ڼ�����Һ��Cu2O+2H+ =Cu2++Cu+H2O��
������Cu2O�ķ�Ӧ��4Cu(OH)2+N2H4H2O=2Cu2O+N2��+7H2O
��ش�
��1������II��д������CuR2��Ӧ�����ӷ���ʽ��____________________________
��2������II�����ˮ������ȡ���ϲ���ȡҺ��Ŀ����___________________________
��3������III������ȡ��Ϊ_____________
��4������IV�����Ʊ�����Cu2Oʱ��������Һ��pHΪ5��ԭ����_______________
A.  B.
B.  C.
C. 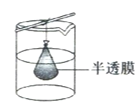
�ڴ���Һ�з��������Cu2O�������ķ������з���Ҳ�ɷ���Cu2O����_________
��Cu2O����ķ�����_________________
��5��Ϊ�ⶨ��Ʒ��Cu2O�ĺ�������ȡ3.960g��Ʒ����ƿ�У�����30mL�����ữ��Fe2(SO4)3��Һ������������ַ�Ӧ����0.2000 mol��L��1��KMnO4��Һ�ζ����ظ�2��3�Σ�ƽ������KMnO4��Һ50.00mL��
�ٲ�Ʒ��Cu2O����������Ϊ_______
�����������ⶨ�������ƫ�ߵ�ԭ����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫��Ĥ������һ�����������ļ������뵽�˹�ҵ���Σ�ij����С���о����� BMEDĤ��(��ͼ��ʾ)��ģ���Ծ���Ũ��ˮΪԭ��ֱ���Ʊ���ͼBMEDĤ�Ѱ��������ӽ���Ĥ�������ӽ���Ĥ��˫��Ĥ( a . d)����֪����ֱ����Դ�������£�˫��Ĥ���м����㷢��ˮ�Ľ��룬���� H+ �� OH-������˵����ȷ����
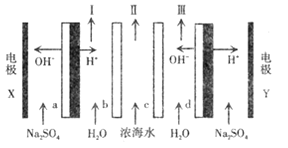
A.�缫 Y���ӵ�Դ��������������ԭ��Ӧ
B.�������Һ����Na2SO4 ��Һ�ɱ����к�����IJ���
C.I ���ų����ǻ�ϼII ���ų����ǵ�ˮ
D.a���ĤΪ�����ӽ���Ĥ ��c Ϊ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ��Ϊ0.100 0 mol��L1��NaOH��Һ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.100 0 mol��L1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ����
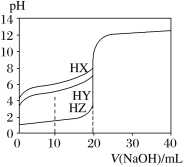
A.����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX
B.���ݵζ����߿ɵ�Ka(HX)����������107
C.HX��HY��HZ��Һ�о���������ƽ��
D.HY��HZ��ϣ��ﵽƽ��ʱc(H��)��![]() ��c(Z)��c(OH)
��c(Z)��c(OH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫�����������ڽ���Ѫ���еĵ��̴�����ṹ��ʽΪ�� 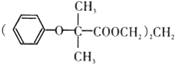
�����ʵĺϳ�·����ͼ��ʾ��
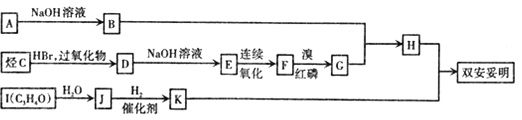
��֪��I. 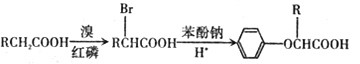
II.RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
III.C���ܶ���ͬ��ͬѹ�������ܶȵ�28 ������֧����һ������I �ܷ���������Ӧ��1 molI���� 2molH2 �����ӳɷ�Ӧ��K �Ľṹ���жԳ��ԡ�
��ش��������⣺
(1)A�Ľṹ��ʽΪ ___________��J����������������Ϊ_________��
(2)D������Ϊ__________ ��
(3)��ӦD��E�Ļ�ѧ����ʽΪ ___________���䷴Ӧ������__________��
(4)��H+K��˫���������Ļ�ѧ����ʽΪ ___________��
(5)LΪ��H����Է�������С14��ͬϵ���������ٱ�����������ȡ�������� ������һ�ȴ���ֻ�����֣�������FeCl3��Һ������ɫ��Ӧ������������L��_______�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��CO(g)��CuO(s)![]() CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
A. ��Ӧ�ٵ�ƽ�ⳣ��K1��c(CO2).c(Cu)/c(CO).c(CuO)
B. ��Ӧ�۵�ƽ�ⳣ��K��K1/K2
C. ���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�Ӧ���ʱ�Ϊ��ֵ
D. ���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�Ǧ�⣨CH3NH3PbI3������ȫ��̬���ѿ�����̫���ܵ�ص�������������CH3NH2��PbI2��HIΪԭ�Ϻϳɣ��ش��������⣺
��1����ȡ�װ��ķ�ӦΪCH3OH��g����NH3��g��![]() CH3NH2��g����H2O��g������H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
CH3NH2��g����H2O��g������H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
���ۼ� | C��O | H��O | N��H | C��N | C��H |
����/kJ��mol��1 | 351 | 463 | 393 | 293 | 414 |
��÷�Ӧ����H��____kJ��mol��1��
��2��������Ӧ������ļ״���ҵ������ˮú���ϳ�CO��g����2H2��g��![]() CH3OH��g������H<0����һ�������£���1 mol CO��2 mol H2ͨ���ܱ������н��з�Ӧ�����ı�ijһ����������¶Ȼ�ѹǿ��ʱ��CH3OH�������������CH3OH���仯������ͼ��ʾ��
CH3OH��g������H<0����һ�������£���1 mol CO��2 mol H2ͨ���ܱ������н��з�Ӧ�����ı�ijһ����������¶Ȼ�ѹǿ��ʱ��CH3OH�������������CH3OH���仯������ͼ��ʾ��
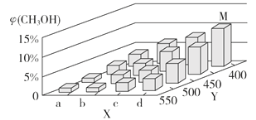
��ƽ��ʱ��M��CH3OH���������Ϊ10%����CO��ת����Ϊ___��
��X����a�����ֵ��b��____ ��������������С������ijͬѧ��Ϊ��ͼ��Y���ʾ�¶ȣ�����Ϊ���жϵ�������_________________��
��3����ҵ�Ͽɲ���CH3OH CO+2H2 ����ȡ�ߴ��ȵ�CO��H2���ҹ�ѧ�߲���������ѧ������ͨ�������ģ�⣬�о������ٻ����������ϼ״�����ķ�Ӧ���̣������������ٴ��������ϵ�������*��ע��
CO+2H2 ����ȡ�ߴ��ȵ�CO��H2���ҹ�ѧ�߲���������ѧ������ͨ�������ģ�⣬�о������ٻ����������ϼ״�����ķ�Ӧ���̣������������ٴ��������ϵ�������*��ע��
�״���CH3OH�����ⷴӦ�ĵ�һ�����̣������ֿ��ܷ�ʽ��
��ʽ A��CH3OH* ��CH3O* ��H* Ea= +103.1kJ��mol-1
��ʽ B��CH3OH* ��CH3* ��OH* Eb= +249.3kJ��mol-1
�ɻ��Eֵ�Ʋ⣬�״��ѽ������Ҫ�����ķ�ʽӦΪ___����A��B����
��ͼΪ�����ģ��ĸ�����Ӧ�������仯ʾ��ͼ��
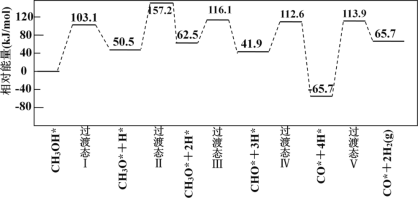
�������У��������IJ���Ļ�ѧ����ʽΪ________��
��4��PbI2��������LiI-Al2O3����Ϊ��������﮵��أ���ṹʾ��ͼ���£�����ܷ�Ӧ�ɱ�ʾΪ��2Li+PbI2=2LiI+Pb����b���ϵĵ缫��ӦʽΪ��_____��

��5��CH3NH2�ĵ��뷽��ʽΪCH3NH2+H2O![]() CH3NH3++OH-���볣��Ϊkb����֪������pkb=-lgkb=3.4����������CH3NH2��Һ�μ�ϡ������c��CH3NH2��=c��CH3NH3+��ʱ����ҺpH=______��
CH3NH3++OH-���볣��Ϊkb����֪������pkb=-lgkb=3.4����������CH3NH2��Һ�μ�ϡ������c��CH3NH2��=c��CH3NH3+��ʱ����ҺpH=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҳ�����������·�Ӧ��ȡ����������2KMnO4+16HCl(Ũ)![]() 2KCl+2MnCl2+8H2O+5Cl2�������ڸ÷�Ӧ��˵����ȷ���ǣ� ��
2KCl+2MnCl2+8H2O+5Cl2�������ڸ÷�Ӧ��˵����ȷ���ǣ� ��
A.KMnO4�е���Ԫ�ر�����
B.Cl2��������������ǻ�ԭ����
C.HCl�ڷ�Ӧ��ֻ����ԭ��
D.ÿ����1molCl2ת�Ƶ��ӵ����ʵ���Ϊ2mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com