
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
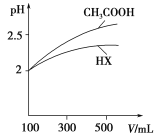
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为 ______________________,请用化学用语解释出现此现象的原因___________________;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____Fe2+____NO3-+____H+ = ___Fe3++____NO↑+_____H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物杜瓦苯(![]() )的说法中错误的是
)的说法中错误的是
A.杜瓦苯与苯互为同分异构体
B.杜瓦苯的二氯代物共有六种(不含立体异构)
C.杜瓦苯中所有的碳原子可能共平面
D.杜瓦苯可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. X和Y的转化率相等
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
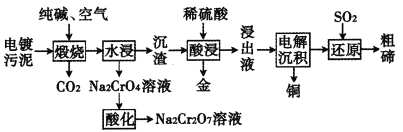
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)Te元素在元素周期表中的位置为______________其基态原子的电子占据的最高能层符号为________。
(2)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________(填化学式)。电解沉积过程中析出单质铜的电极为_________极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
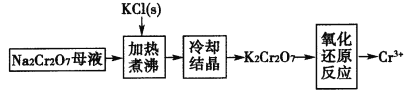
通过冷却结晶能析出大量K2Cr2O7的原因是______________。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000 mol·L-1(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为____________________。
若三次实验消耗(NH4)2Fe(SO4)2标准液的体积平均为25.00 mL,则所得产品中K2Cr2O7的纯度为________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学在学习了二氧化碳与过氧化钠的反应后,对过氧化钠与二氧化硫的反应进行实验探究。
(1)提出假设:
假设1. 固体产物是Na2SO3
假设2. _________________________
假设3. 固体产物是Na2SO3和Na2SO4的混合物。
(2)实验验证:用如图所示装置对上述假设进行实验。
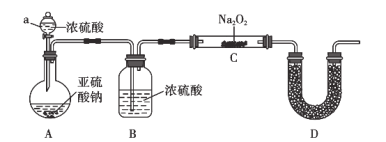
(1)仪器a的名称为__________,装置A中发生反应的化学方程式为:________________________。
(2)装置B的作用为________________________,装置D中试剂的名称为________。
(3)装置C中固体完全反应后,得到白色固体,进行如下实验。
实验操作 | 预期现象与结论 |
步骤1.取少量白色固体于试管中,加入足量的稀盐酸,将生成的气体通入品红溶液。 | 若_____________,说明白色固体中含有Na2SO3。 |
步骤2.在步骤1反应后的溶液中加入________ | 若_____________,说明白色固体中含有Na2SO4。 |
通过实验探究发现上述两个实验现象均有,则说明假设3正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅![]() SiCl4
SiCl4![]() Si
Si
B.Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D.AgNO3(aq)![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)![]() Ag
Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com