
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为 ______________________,请用化学用语解释出现此现象的原因___________________;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____Fe2+____NO3-+____H+ = ___Fe3++____NO↑+_____H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
【答案】Fe+2Fe3+=3Fe2+ 产生白色沉淀,迅速变为灰绿色最后变为红褐色 Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3 1 4 3 1 2 A 取少量反应后溶液于试管,往其中滴加少量酸性高锰酸钾溶液,若溶液颜色变浅或褪色,则溶液中含Fe2+,否则不含Fe2+ 4.48
【解析】
(1).![]() 变质时二价铁被氧化为三价铁,利用
变质时二价铁被氧化为三价铁,利用![]() ,可以在配制二价铁溶液时防止变质;
,可以在配制二价铁溶液时防止变质;
(2).![]() 是弱碱盐,会和氨水发生反应生成弱碱
是弱碱盐,会和氨水发生反应生成弱碱![]() ,
, ![]() 极易被氧化为
极易被氧化为![]() ;
;
(3). ①.氧化还原方程式配平找出反应中的氧化剂,还原剂,氧化产物,还原产物,分析价态变化利用元素守恒和电荷守恒配平;
②. ![]() 具有还原性可以使有色氧化剂因发生氧化还原反应褪色,所以可以据此检验二价铁是否存在;
具有还原性可以使有色氧化剂因发生氧化还原反应褪色,所以可以据此检验二价铁是否存在;
③.离子检验一般遵循步骤为:取样液于试管中,滴加检验试剂,描述现象结合现象得出结论;
④.![]() ,依据反应中
,依据反应中![]() 与
与![]() 以及转移电子之间的关系进行求解;
以及转移电子之间的关系进行求解;
(1)在试管中加入少量绿矾样品,加水溶解,配制成![]() 溶液。在溶液中需加入少量铁屑,其目的是防止
溶液。在溶液中需加入少量铁屑,其目的是防止![]() 被氧化:
被氧化:![]() ,故答案为:
,故答案为:![]() ;
;
(2)向 ![]() 溶液滴加氨水生成白色沉淀氢氧化亚铁,迅速变为灰绿色,最后变为红褐色,发生的反应为:
溶液滴加氨水生成白色沉淀氢氧化亚铁,迅速变为灰绿色,最后变为红褐色,发生的反应为:![]() ,
,![]() ,故答案为:产生白色沉淀,迅速变为灰绿色最后变为红褐色;
,故答案为:产生白色沉淀,迅速变为灰绿色最后变为红褐色;![]() ;
;![]() ;
;
(3)①![]() 氧化为
氧化为![]() ,失去1个电子,稀硝酸被还原为
,失去1个电子,稀硝酸被还原为![]() ,N元素得到3个电子,根据得失电子守恒,
,N元素得到3个电子,根据得失电子守恒,![]() 的计量数为3,
的计量数为3,![]() 的计量数为1,结合电荷守恒可知H+的计量数为4,结合原子守恒可知
的计量数为1,结合电荷守恒可知H+的计量数为4,结合原子守恒可知![]() 的计量数为2,故答案为:3;1;4;3;1;2;
的计量数为2,故答案为:3;1;4;3;1;2;
②![]() 具有还原性,可将酸性
具有还原性,可将酸性![]() 溶液还原变色,所以可用酸性
溶液还原变色,所以可用酸性![]() 溶液检验该反应后的溶液中是否还含有
溶液检验该反应后的溶液中是否还含有![]() ,故答案为:A;
,故答案为:A;
③![]() 具有还原性,可将酸性
具有还原性,可将酸性![]() 溶液还原,使溶液颜色变浅或褪色,上述②的具体实验方案为:取少量反应后溶液于试管,往其中滴加少量酸性高锰酸钾溶液,若溶液颜色变浅或褪色,则溶液中含
溶液还原,使溶液颜色变浅或褪色,上述②的具体实验方案为:取少量反应后溶液于试管,往其中滴加少量酸性高锰酸钾溶液,若溶液颜色变浅或褪色,则溶液中含![]() ,否则不含
,否则不含![]() ,故答案为:取少量反应后溶液于试管,往其中滴加少量酸性高锰酸钾溶液,若溶液颜色变浅或褪色,则溶液中含
,故答案为:取少量反应后溶液于试管,往其中滴加少量酸性高锰酸钾溶液,若溶液颜色变浅或褪色,则溶液中含![]() ,否则不含
,否则不含![]() ;
;
④100mL6mol/L![]() 溶液中,
溶液中,![]() =0.1L×6mol/L=0.6mol,
=0.1L×6mol/L=0.6mol,![]() 溶与稀硝酸反应的离子方程式为:
溶与稀硝酸反应的离子方程式为:![]() ,由方程式可知,3mol
,由方程式可知,3mol![]() 完全反应生成标准状况下
完全反应生成标准状况下![]() 22.4L,所以0.6mol完全反应生成标准状况下
22.4L,所以0.6mol完全反应生成标准状况下![]() 4.48L,故答案为:4.48。
4.48L,故答案为:4.48。


科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
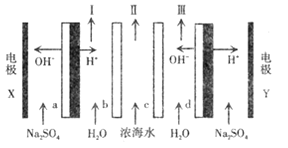
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=____kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
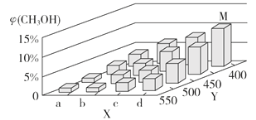
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点____ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_________________。
(3)工业上可采用CH3OH CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
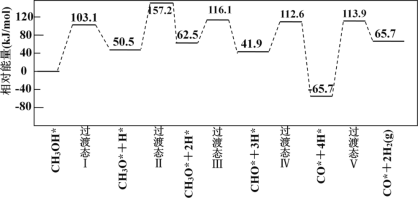
该历程中,放热最多的步骤的化学方程式为________。
(4)PbI2与金属锂以LiI-Al2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb,则b极上的电极反应式为:_____。

(5)CH3NH2的电离方程式为CH3NH2+H2O![]() CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇是工业常见的有机原料,常用来制取纺织工业的乙二醛和化妆品行业的乙醛酸。
①乙二醇(HOCH2CH2OH)气相催化氧化法制取乙二醛(OHC-CHO),主要反应为:HOCH2CH2OH(g)+O2(g)![]() OHC—CHO(g)+2H2O(g) H
OHC—CHO(g)+2H2O(g) H
化学键 | O—H | C—H | C—O | C=O | O=O | C—C |
键能(kJ·mol-1) | 436 | 413 | 356 | 745 | 493 | 346 |
则H=_____kJ·mol-1。
②当原料气中氧醇比(氧气和乙二醇的物质的量之比)一定时,乙二醛和副产物CO2的产率与反应温度的关系如图所示,则反应中应控制的适宜温度是___(填字母)。
a.低于450℃
b.450℃~490℃
c.高于495℃
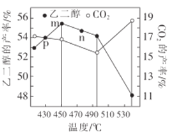
p、m、n三点中____是平衡点,__是逆反应速率最快的点。
③温度超过495℃时,乙二醛的产率直线下降的原因是___。
(2)将乙二醇氧化为乙二酸,再利用乙二酸(HOOCCOOH)通过电解制备乙醛酸,阴极的电极反应式为____。
(3)液相氧化制备乙醛酸是近年研究的热点。向25L某浓度的乙二醛溶液中,加入适量的催化剂V2O5/C,以0.1mol·L-1的流速通入氧气,测得溶液中乙二醛的浓度、溶液的pH随时间变化的关系如图所示:
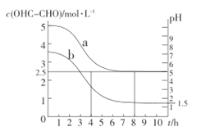
①图中曲线___(填“a”或“b”)表示溶液的pH值随时间变化的曲线。
②V2O5/C表示将催化剂覆盖在纳米碳纤维上,其目的是___。
③写出制备乙醛酸(HOC—COOH)的化学反应方程式:____,根据图中数据算出8h内乙醛酸的平均生成速率v(HOC—COOH)=____;该实验条件下乙醛酸的电离常数Ka=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式_____________ ;
(2)用如图所示装置可检验木炭和浓硫酸反应产生的混合气体中含有SO2和CO2。
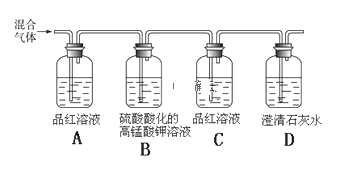
①能够证明混合气体中含有SO2的实验现象是:________________________________;
②设计B、C的实验目的是:________________________________________________;
③写出B中发生反应的离子方程式:_____________________________;
④能够证明混合气体中含有CO2的实验现象是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Z是合成某药物的中间体,其合成原理如下:
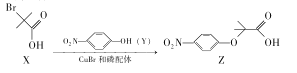
下列说法正确的是.
A.用NaHCO3溶液可以鉴别X和ZB.X、Y、Z都能发生取代反应
C.X分子所有碳原子可能共平面D.与X具有相同官能团的同分异构体还有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁铝、聚合氯化铝是高效水处理剂。以废铁屑、废铝质易拉罐及硫酸为原料,制备聚合硫酸铁铝的工艺流程如下:
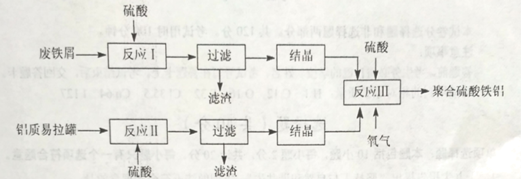
(1) 为提高反应I、II金属元素的浸出率,可以采取的措施有___。
(2) 反应III中FeSO4转化为Fe2(SO4)3的化学方程式为_____。
(3) 反应III的温度应控制在50℃~70℃为宜,原因是_____。反应II过程中往往加入少量硝酸铝,其作用如图16-1所示,转化①的离子方程式为___。
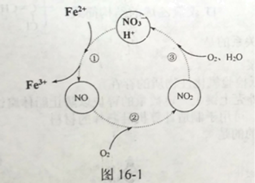
(4) 写出Fe2(SO4)3 水解生成Fe2(OH)n(SO4)3-n/2 的离子方程式:_____。
(5) 利用图16-2所示电解装置可制备净水剂聚合氯化铝。实际生产中,阳极附近因为副反应可能产生的气体有____________。
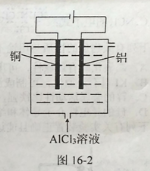
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com