
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
科目:高中化学 来源: 题型:
【题目】已知CaH2中Ca为+2 价,在该反应CaH2+2H2O=Ca(OH)2+2H2↑中,下列说法正确的是
A.CaH2是氧化剂B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原D.氧化产物与还原产物的质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为 A、B 元素的原子结构示意图。下列说法错误的是( )

A.B 的原子结构示意图中 x 为 12
B.A 和 B 分别属于非金属元素和金属元素
C.A 的原子和 B 的原子分别形成简单离子的过程相同
D.A 与 B 可组成化学式为 BA2 的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于可逆反应的理解不正确的是( )
A.可逆反应是指既能向正反应方向进行,又能向逆反应方向进行的反应
B.可逆反应的反应物与生成物之间只能用可逆号,而不能用等号
C.可逆反应的正反应和逆反应条件完全相同
D.可逆反应中,反应物不能全部转化为生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建国70周年阅兵式上,飞机拉烟原理是吊舱中的彩烟剂被加压N2吹出,送入高温尾气中,尾气中的蒸汽遇冷凝结成雾,形成“彩烟”。下列有关说法正确的是( )
A.彩烟是一种纯净物
B.蒸汽凝结为雾发生了化学变化
C.蒸汽遇冷形成的雾是一种分散系
D.拉烟原理与焰色试验的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请分别以钙和碳为例,用化学方程式表示下列转化关系
Ca→CaO→Ca(OH)2→CaCO3
C→CO2→H2CO3→CaCO3
A. ___________________________
B. ____________________________
C. ____________________________
D.____________________________
E. ____________________________
F.____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某空间站能量转化系统的局部示意图:其中燃料池采用KOH溶液为解液,下列有关说法中不正确的是( )

A.燃料电池系统产的能量实际上来自于太阳能
B.该能量转化系统中的水可以循环利用
C.背日面时,燃料电池负极反应为:H2+2OH﹣﹣2e﹣═2H2O
D.向日面时,水电解产生的H2和O2的体积比为1:2(相同条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.2kJ/mol
CO(g)+H2O(g) △H2=+41.2kJ/mol
III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
某些物质的标准生成热 | ||||
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。化学反应热:ΔH=生成物标准生成热总和一反应物标准生成热总和。计算 △H1=_____kJ/mol。
(2)在一容积可变的密团容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
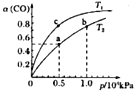
①a、b两点的反应速率:v(a)___v(b)(填“>”、“<”或“=”)
②T1____T2(填“>”、“<"或“=”),原因是___________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是_____(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数Kp____(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用下图简单表示,则阳极发生的电极反应为_________。
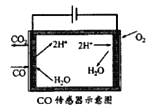
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com