
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
分析 醋酸钠溶液中存在水解平衡:Ac-+H2O?HAc+OH-,根据条件改变对水解平衡的影响以及溶解热对体系温度的影响进行判断.
解答 解:醋酸钠溶液中存在水解平衡:Ac-+H2O?HAc+OH-,
①少量KNO3固体溶于水时吸热,导致体系温度降低,平衡逆向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$增大;
②加入少量硫酸氢钾固体,硫酸氢钾电离产生的氢离子与氢氧根离子反应,降低了c(OH-),平衡正向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
③氯化钠固体溶于水,增大了c(Na+),对平衡无影响,c(Ac-)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
④加入少量硫酸铜粉末,铜离子和氢氧根离子反应,降低了c(OH-),平衡正向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
故选C.
点评 本题考查了影响盐类水解的因素,题目难度中等,注意绝热条件下KNO3固体溶于水吸热导致体系温度降低,水解平衡逆向移动.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
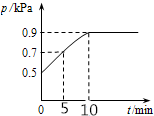 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
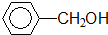 酚类-OH
酚类-OH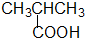 羧酸类-COOH
羧酸类-COOH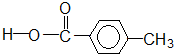 醛类
醛类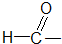
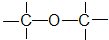
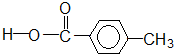 酯类
酯类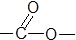
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 标准状况下,22.4 L苯所含的分子数 | |
| C. | 室温下,8 g甲烷含有共价键数为2NA | |
| D. | 1 L 1 mol•L-1硫酸溶液所含的H+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 纯铁的硬度和强度均高于铁合金 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 一定条件下,铁粉可与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | B. | 单质分子一定是非极性分子 | ||
| C. | 氢键一定与氢元素有关 | D. | 共价键只存在于非金属元素之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com