
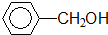 酚类-OH
酚类-OH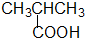 羧酸类-COOH
羧酸类-COOH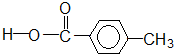 醛类
醛类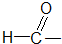
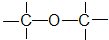
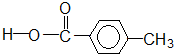 酯类
酯类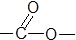
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | K+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | A13+、Na+、A1O2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
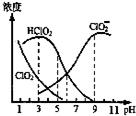
| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 由水电离出的c(H+)c(OH-)═10-22的溶液:Fe2+、Na+、NO3-、SO42- | |
| D. | 澄清透明的溶液中SO42-、K+、Cu2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com