
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
分析 (1)计算出甲烷的物质的量,根据方程式计算氢气的物质的量;
(2)利用端值法计算,假设气体全部和水或氧气反应,根据方程式判断;
(3)根据反应的方程式结合表中数据列方程式计算;
(4)设富氧空气为1mol,则氧气为0.25mol,氮气为1mol-0.25mol=0.75mol,令水的物质的量为ymol,根据反应①、②计算出反应生成氢气的物质的量,根据氢气与氮气的物质的量之比列方程,据此计算解答.
解答 解:(1)1m3(标准状况)CH4的物质的量为$\frac{1000L}{22.4L/mol}$=44.6mol,
CH4(g)+H2O(g)→CO(g)+3H2(g)
1mol 3mol
44.6mol n
n=44.6×3mol=134mol,
故答案为:134;
(2)根据方程式可知,1m3甲烷完全和氧气反应生成3m3气体,完全和水反应生成4m3气体,
则产物气体的体积V(标准状况)为3m3<V<4m3,
故答案为:3<V<4;
(3)设H2O为xmol,O2为ymol,则$\left\{\begin{array}{l}{x+2y=25}\\{3x+4y=60}\end{array}\right.$
x=10,y=7.5
$\frac{VO{\;}_{2}}{VN{\;}_{2}}$=$\frac{2.5+7.5}{15}$=2:3,
故答案为:$\frac{2}{3}$;
(4)设富氧空气为ymol,富氧空气中O2的体积分数为a,反应用去的H2O(g)xmol,
设则氧气为0.25mol,氮气为1mol-0.25mol=0.75mol,令水的物质的量为ymol,则:
CH4(g)+H2O→CO(g)+3H2(g)
xmol xmol 3xmol
2CH4(g)+O2(g)→2CO(g)+4H2
aymol 2aymol 4aymol
则(3x+4ay)mol:(y-ay)mol=3:1,解得x:y=(3-7a):3,
则反应中的H2O(g)和富氧空气的物质的量之比为(3-7a):3,
故答案为:(3-7a):3.
点评 本题考查了化学方程式计算分析,注意元素守恒的计算应用和化学方程式定量关系的理解分析,掌握基础是关键,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
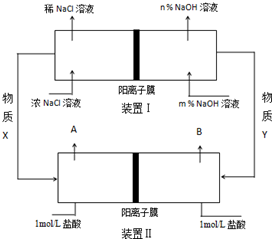
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,钢铁制品和铝制品都容易发生吸氧腐蚀 | |
| B. | 聚乙烯塑料易老化,是因为发生了加成反应 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 空气质量指标中有一项指标名称为PM2.5,指的是空气中直径≤2.5微米的固体或液体的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
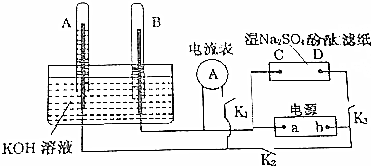
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
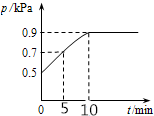 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
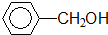 酚类-OH
酚类-OH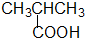 羧酸类-COOH
羧酸类-COOH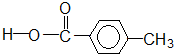 醛类
醛类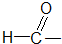
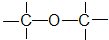
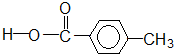 酯类
酯类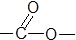
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )| A. | 化学方程式中:m+n>e | |
| B. | 达到平衡后,使用催化剂,C的体积分数将增大 | |
| C. | 达到平衡后,若温度升高,化学平衡向逆反应方向移动 | |
| D. | 达到平衡后,若增大体系的压强,化学平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com