
下列各组物质中,不能用酸性高锰酸钾溶液鉴别的是
| A.乙酸和乙醛 | B.丁二烯和乙烯 |
| C.苯和甲苯 | D.丙烯和丙烷 |
科目:高中化学 来源: 题型:实验题
某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1 的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6 (Na2S4O6溶液为无色)。试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)步骤①反应的离子方程式是 。
(3)步聚③当待测液由 色变为 色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行试验探究时,欲配制1.0molL-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
为探究原因,该同学查得Ba(OH)2·8H2O 部分溶解度数据,见下表:
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | ###### |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | _______________________ |
| 步骤3:取适量步骤1中的沉淀于试管中, ,连接带塞导气管将产生的气体导入澄清石灰水中。 | _______________________ ______________________ |
| 步骤4:取步骤1中的滤液于烧杯中,______________________________ | _______________________,说明该试剂中含有Ba(OH)2。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下: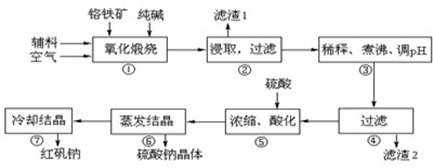
中涉及的主要反应有:
主反应:4FeO?Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作中错误的是( )
| A.过滤操作时如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次 |
| B.蒸馏操作时,应使温度计水银球插入液态混合物中 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤; ②加过量NaOH溶液; ③加过量盐酸; ④加过量Na2CO3溶液; ⑤加过量BaCl2溶液。其中正确的操作顺序
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液区别的一种试剂是( )
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com