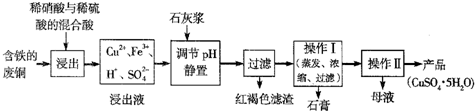
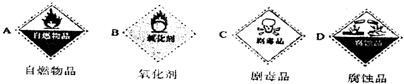
解:(1)因浓硫酸具有强烈的腐蚀性、强氧化性,则选择的标签为BD,故答案为:BD;
(2)灰白色的固体中加入适量蒸馏水,若观察到溶液为蓝色,则所得白色固体为CuSO
4,故答案为:溶液为蓝色;CuSO
4;
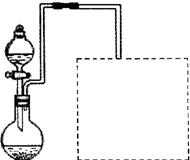
(3)试管内壁上部析出少量淡黄色固体物质,由存在的元素可知淡黄色固体物质为S,S具有还原性,浓硫酸具有强氧化性,
S与浓硫酸发生氧化还原反应为S+2H
2SO
4(浓)

3SO
2↑+2H
2O,而使淡黄色物质消失,故答案为:S+2H
2SO
4(浓)

3SO
2↑+2H
2O;
(4)由2Cu+O
2
2CuO,CuO+H
2SO
4=CuSO
4+H
2O可知,不生成有毒气体二氧化硫,则其优点为不产生有毒气体污染环境,故答案为:生成物对环境无污染;
(5)铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,是发生了氧化还原反应所致,该反应为Cu+H
2O
2+H
2SO
4═CuSO
4+2H
2O,
故答案为:Cu+H
2O
2+H
2SO
4═CuSO
4+2H
2O;
(6)Cu与稀硫酸不反应,若只用铜和稀硫酸为原料制取硫酸铜,则可设计为电解池,让Cu作阳极,硫酸作电解质溶液,反应为Cu+H
2SO
4
CuSO
4+H
2↑,
故答案为:Cu+H
2SO
4
CuSO
4+H
2↑.
分析:(1)根据浓硫酸具有强烈的腐蚀性、强氧化性来选择合适的标签;
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,以此来分析;
(3)由存在的元素可知淡黄色固体物质为S,S与浓硫酸发生氧化还原反应而使其消失;
(4)该过程中不生成有毒气体二氧化硫;
(5)Cu作还原剂,双氧水作氧化剂,发生氧化还原反应生成硫酸铜;
(6)只用铜和稀硫酸为原料制取硫酸铜,则可设计为电解池来实现该反应.
点评:本题考查浓硫酸的性质,明确浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,难度不大.

 2CuO,CuO+H2SO4=CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是______.
2CuO,CuO+H2SO4=CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是______. 3SO2↑+2H2O,而使淡黄色物质消失,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O,而使淡黄色物质消失,故答案为:S+2H2SO4(浓) 3SO2↑+2H2O;
3SO2↑+2H2O; 2CuO,CuO+H2SO4=CuSO4+H2O可知,不生成有毒气体二氧化硫,则其优点为不产生有毒气体污染环境,故答案为:生成物对环境无污染;
2CuO,CuO+H2SO4=CuSO4+H2O可知,不生成有毒气体二氧化硫,则其优点为不产生有毒气体污染环境,故答案为:生成物对环境无污染; CuSO4+H2↑,
CuSO4+H2↑, CuSO4+H2↑.
CuSO4+H2↑.