
【题目】根据下列图示得出的结论不正确的是( )
A.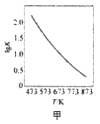 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.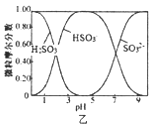 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.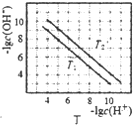 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 天然气和沼气的主要成分都是甲烷,它们都属于不可再生能源
B. 煤的气化和液化均属于物理变化
C. 石油裂解的目的是为了得到更多的汽油
D. 用含糖类、淀粉比较多的农作物为原料,在催化剂作用下,经水解和细菌发酵制乙醇的过程属于生物质能的利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
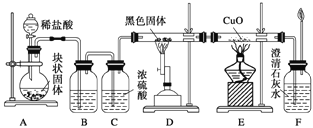
(1)写出装置A中发生反应的化学反应方程式:_______________________。
(2)装置B中最适宜的试剂是:_________________________。
(3)装置D中黑色固体为_____________(填名称),反应的化学方程式为:_____________________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: ___________________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是_____________。
(6)根据实验中的_________________现象,可证明CO具有还原性,有关反应的化学方程式是___________________________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的___________装置(填序号)。
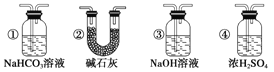
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
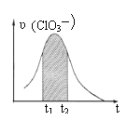
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以苯胺为原料,按以下反应原理和流程合成对氨基苯磺酸
![]() +H2SO4
+H2SO4 ![]()
![]() +H2O
+H2O
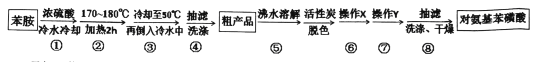
已知:苯胺是一种无色油状液体,微溶于水,易溶于乙醇,熔点-6.1℃,沸点184.4℃。对氨基苯磺酸是一种白色晶体,微溶于冷水,可溶于沸水,易溶于碱性溶液,不溶于乙醇。
(1)下列操作或描述不正确的是________
A.步骤①浓硫酸要分批滴加且不断振荡,并在冰水中冷却目的是为防止苯胺的挥发或碳化
B.步骤③倒入冷水中后,若没有析出晶体,可用玻璃棒搅拌或加入晶种促进晶体析出
C.步骤②加热采用水浴加热,其优点是反应物受热均匀,便于控制温度
D.实验装置中温度计可以改变位置,也可使其水银球浸入在浴液中
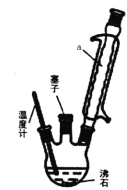
(2)步骤②反应时如图所示装置中进行,其中仪器a的名称_________ 。步骤④中洗涤剂最好选择 ______ 洗涤沉淀的操作是______________。
A. 15%的乙醇 B.热水 C. 冷水 D.NaOH溶液
(3)苯胺与足量浓硫酸反应后,为验证苯胺是否完全反应,可取出几滴反应混合液滴到5-6mL10% NaOH溶液,若 _________现象则认为反应已基本完全。
(4)步骤⑥中操作X为__________,实验有时需要将步骤⑤、⑦、⑧的操作重复多次,其目的是______________________。
(5)苯胺与浓硫酸混合时会反生副反应产生盐类物质,写出其反应化学方程式____。
(6)步骤⑤至⑧过程 ,下列装置肯定用不到的是___ ,若制得的晶体颗粒较小,分析可能的原因______(写出两点)。
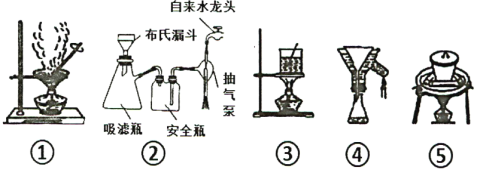
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式:_____________________________
(2)干燥管C内盛放的药品可以是______或________(填化学式)。干燥管的________(填“m”或“n”)端与g导管相连接。
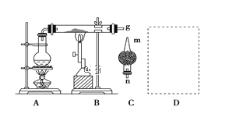
(3)在g处用试管收集氢气,简述用简单的方法检验收集到的气体是氢气的实验操作步骤和现象:_______________________________________
(4)停止反应后,待B处硬质玻璃管冷却后,取其中固体溶于过量的稀盐酸充分反应得溶液a,
①欲检验溶液中含有Fe3+,选用的试剂为溶液,现象是______________。
②该实验小组用上述试剂没有检测到Fe3+, 另取溶液a,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色,溶液中反应的离子方程式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示。下列说法正确的是( )

A.电流从电极A经过负载后流向电极B
B.为使电池持续放电,离子交换膜只允许阴离子通过
C.电极A的电极反应式为:2NH3-6e-=N2+6H+
D.室温下,当有4.48LNO2被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以异丙苯为起始原料,按下列路线合成植物香料花青醛。

已知:(l)RX![]() RMgX
RMgX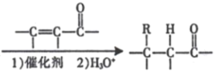 ( R 表示烃基);
( R 表示烃基);
(2)RCHO + R'CH2CHO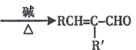 (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
(1)下列说法正确的是__________(填序号)。
A.异丙苯到化合物C 共经历了三步取代反应
B.常温常压下,化合物D可溶于NaOH 溶液
C.化合物B具有弱碱性
D.花青醛的分子式是C13H18O
(2)写出化合物E的结构简式___________。
(3)写出反应①的化学方程式___________。
(4)设计从乙烯到F 的合成路线(用流程图表示,无机试剂任选)_______。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式______。1H-NMR谱和IR谱检测表明:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com