

 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号); ④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号).
④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号).分析 (1)分子晶体的熔点较低,原子晶体熔点高;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性;
(2)①根据一个单键是一个σ键,一个双键中含有一个σ键和1个π键;②根据配合物Fe(CO)5结构分析中心原子为Fe,配体为CO、配位数为5;
(3)根据配合物Ni(CO)4的性质熔点、溶解性判断;原子数目相等、价电子总数也相等的微粒为等电子体;
(4)分子中N原子与Ni形成配位键,H原子与O原子之间形成分子内氢键,其它原子之间还形成共价键;
(5)碳原子采取sp2杂化,说明碳原子杂化轨道为3,杂化轨道数目=σ键数目+孤对电子;
(6)Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用.
解答 解:(1)C60 属于分子晶体,分子晶体的熔点较低,金刚石属于原子晶体,熔点高,所以金刚石熔点>C60的熔点,冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性,故每个水分子周围只有4个紧邻的水分子,
故答案为:>;4;
(2)①COCl2分子的结构式为: ,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
故答案为:D;
②根据配合物Fe(CO)5结构分析,有孤对电子的原子或离子为配体,所以配体为CO,配位数就是配体的个数,所以配位数为5,
故答案为:CO;5;
(3)因为Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,根据相似相溶原理知,固态Ni(CO)4属于分子晶体;与CO互为等电子体的粒子含有2个原子、价电子数目为10,为N2、CN-等,
故答案为:分子;N2、CN-;
(4)分子中N原子与Ni形成配位键,H原子与O原子之间形成分子内氢键,其它原子之间还形成共价键,没有金属键、离子键,
故选:ACE;
(5)CH2=CH2、 、HCHO中碳原子杂化轨道为3,均采取sp2杂化,而CH≡CH中碳原子杂化轨道为2,采取sp杂化,
、HCHO中碳原子杂化轨道为3,均采取sp2杂化,而CH≡CH中碳原子杂化轨道为2,采取sp杂化,
故答案为:①③④;
(6)碳原子位于晶胞体心,只有1个C原子,镁位于顶点,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,镍位于面心,每个镍原子被两个晶胞共用,故每个晶胞中镍原子个数为6×$\frac{1}{2}$=3,故晶体化学式为MgCNi3;Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用,故晶体中每个镁原子周围距离最近的镍原子有12个;
故答案为:12.
点评 本题是对物质结构与性质的考查,涉及氢键、等电子体、化学键、杂化方式、晶胞计算等,会运用价层电子对互斥理论或杂化轨道理论判断空间构型,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 再充入2molNO2,平衡正向移动,O2的体积分数增大 | |
| B. | 升高温度,O2的体积分数减小 | |
| C. | 充入N2,平衡不移动 | |
| D. | 再充入1molO2,NO2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 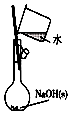 用于配制0.10 mol•L-1 NaOH溶液;评价:正确 | |
| B. |  用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒 | |
| C. | 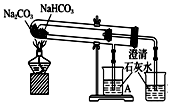 用于比较Na2CO3、NaHCO3的热稳定性;评价:正确 | |
| D. | 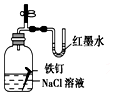 证明铁发生吸氧腐蚀时空气参加反应;评价:正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中FeSO4只做还原剂,Na2O2只做氧化剂 | |
| B. | 反应中氧化剂与还原剂的物质的量之比为3:5 | |
| C. | 该反应中由4 mol Fe2+还原的Na2O2是3 mol | |
| D. | 4 mol Na2O2在反应中共得到8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①②④ | C. | ②④⑥ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明 Cl2的氧化性强于 I2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2 有漂白性 | |
| C. | 向氯水中滴加硝酸酸化的 AgNO 溶液,产生白色沉淀,说明氯水中含有 Cl- | |
| D. | 向氯水中加入 NaHCO 粉末,有气泡产生,说明氯水中含有 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
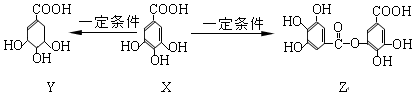
| A. | 1molZ最多能与7molNaOH发生反应 | |
| B. | 1molX最多能与2molBr2发生取代反应 | |
| C. | Y分子结构中有3个手性碳原子 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com