
| A. | 再充入2molNO2,平衡正向移动,O2的体积分数增大 | |
| B. | 升高温度,O2的体积分数减小 | |
| C. | 充入N2,平衡不移动 | |
| D. | 再充入1molO2,NO2的体积分数增大 |
分析 A.再充入2molNO2,相当于增大压强,化学平衡向气体体积减小的方向移动;
B.正反应吸热,升高温度,平衡向正反应方向移动,O2的体积分数增大;
C.增大压强,化学平衡向气体体积减小的方向移动,据此分析;
D.增大生成物的浓度,平衡向逆反应方向移动.
解答 解:A.反应物只有一种,再充入2molNO2,相当于增大压强,平衡向气体体积减小的方向移动,即逆向移动,则O2的体积分数减小,故A错误;
B.正反应吸热,升高温度,平衡向正反应方向移动,O2的体积分数增大,故B错误;
C.氮气不参加反应,则充入N2,平衡不移动,故C正确;
D.再充入1molO2,即增大生成物的浓度,平衡逆向移动,但充入1molO2总物质的量增大,则NO2的体积分数仍然减小,故D错误;
故选C.
点评 本题考查了化学平衡移动原理的判断,为高频考点,侧重考查学生的分析能力,本题注意A项,容器容积固定再充入2molNO2,相当于增大压强,本题难度中等.


科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是阴阳离子间存在的静电引力 | |
| B. | 失电子难的原子获得电子的能力一定强 | |
| C. | 在化学反应中,某元素由化合态变为游离态,该元素被还原 | |
| D. | 电子层结构相同的不同离子,其半径随核电荷数增多而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+的结构示意图: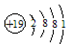 | |
| B. | B、基态氮原子的电子排布图 | |
| C. | 水的电子式: | |
| D. | D、基态铬原子(24Cr)的价电子排布式:3d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓ | |
| C. | NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号); ④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号).
④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Y)<r(X)<r(W)<r(Z) | |
| B. | 元素Z的最高价含氧酸的酸性比W的强 | |
| C. | 元素Y、W的离子具有相同的电子层结构 | |
| D. | Z的简单气态氢化物的热稳定性比W的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com