
【题目】常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:
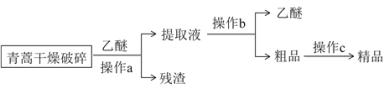
⑴ “破碎”的目的是_______________________________________。
⑵ 操作a和操作b的名称分别是_________、___________。
⑶ 操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷ 操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
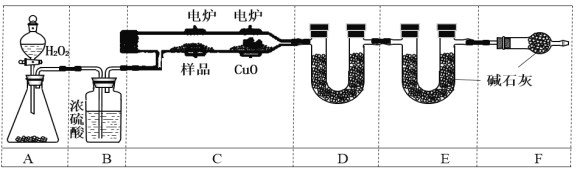
⑸ 实验前至少称量_________个质量数据。
⑹ 装置D中所盛固体可以是____(用对应符号填空);(a.生石灰 b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是_______________________________________。
⑺ A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻ 燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
【答案】扩大接触面积,便于青蒿素被乙醚浸出 过滤 蒸馏 漏斗、烧杯 青蒿素易受湿、热的影响而分解 3 b 防止空气中的H2O和CO2被E吸收而影响实验结果 2∶1(或2) ![]() ×100%
×100%
【解析】
Ⅰ.根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品;
Ⅱ.由实验装置图可知,装置A为用过氧化氢制备氧气的装置,装置B中浓硫酸干燥反应生成的氧气,装置C中青蒿素在电炉中与氧气反应,装置中氧化铜的目的是保证碳元素完全转化为二氧化碳,减少实验误差,装置D中应盛放CaCl2吸收测定水的质量,装置E中盛放碱石灰吸收测定二氧化碳的质量,装置F的作用是防止外界空气中CO2,和H2O进入E装置,影响测定结果。
(1)根据乙醚浸取法的流程可知,对青蒿素进行干燥破碎,可以增大青蒿素与乙醚的接触面积,提高青蒿素的浸取率,故答案为:扩大接触面积,便于青蒿素被乙醚浸出;
(2)根据流程可知,操作a为过滤,操作b的名称是蒸馏,故答案为:过滤;蒸馏;
(3)操作a为过滤,需要的玻璃仪器主要有烧杯、漏斗、玻璃棒,故答案为:漏斗、烧杯;
(4)由题意可知青蒿素易受湿、热的影响而分解,所以操作a所用青蒿必须干燥且不宜加热,故答案为:青蒿素易受湿、热的影响而分解;
(5)测定青蒿素(烃的含氧衍生物)中氧元素的质量分数,应该知道样品的质量、反应生成二氧化碳和水的质量,则实验前至少称量样品、装置D(测定水的质量)和装置E(测定二氧化碳的质量)的质量,故答案为:3;
(6)因二氧化碳吸收需用到碱石灰固体,所以吸收水的试剂一定不能与二氧化碳反应,则装置D中应盛放CaCl2吸收测定水的质量,装置E中盛放碱石灰吸收测定二氧化碳的质量,装置F的作用是防止外界空气中CO2和H2O进入E装置,影响测定结果,故答案为:b;防止空气中的H2O和CO2被E吸收而影响实验结果;
(7)H2O2在二氧化锰催化作用下分解的化学方程式为2H2O2 ![]() 2H2O+O2↑,由方程式可知生成1mol O2消耗2mol H2O2,高锰酸钾与过氧化氢发生氧化还原反应的化学方程式为2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O,由方程式可知生成1mol O2消耗1mol H2O2,则产生等量O2,消耗H2O2的物质的量之比为2:1,故答案为:2:1;
2H2O+O2↑,由方程式可知生成1mol O2消耗2mol H2O2,高锰酸钾与过氧化氢发生氧化还原反应的化学方程式为2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O,由方程式可知生成1mol O2消耗1mol H2O2,则产生等量O2,消耗H2O2的物质的量之比为2:1,故答案为:2:1;
(8)由题意可知,燃烧m g青蒿素生成ag水、bg二氧化碳,由原子个数守恒可知,m g青蒿素中H的质量为![]() ×2×1g/mol,C的质量为
×2×1g/mol,C的质量为![]() ×12g/mol,则O的质量为m—
×12g/mol,则O的质量为m—![]() —
—![]() ,氧元素的质量分数为
,氧元素的质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A.两溶液中由水电离的![]() :盐酸>醋酸
:盐酸>醋酸
B.两溶液中![]()
C.分别与足量的金属锌反应生成氢气的量:盐酸>醋酸
D.分别用水稀释相同倍数后溶液的pH:盐酸=醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,化合物H3CCH(CH2CH3)CH2CH(CH3)2的名称为![]() 甲基
甲基![]() 乙基戊烷
乙基戊烷
B. 等质量的甲烷、乙烯、![]() ,
,![]() 丁二烯分别充分燃烧,所耗用氧气的量依次减少
丁二烯分别充分燃烧,所耗用氧气的量依次减少
C. 苯酚、水杨酸(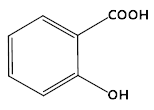 )和苯甲酸都是同系物
)和苯甲酸都是同系物
D. 三硝基甲苯的分子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散是一种新型杀虫剂,防效迅速,且残效不长,对水稻叶蝉和飞虱具有较强的触杀作用。工业上用邻异丙基苯酚合成叶蝉散的过程如下:

邻异丙基苯酚 叶蝉散
下列有关说法不正确的是 ( )
A. 叶蝉散的相对分子质量为193B. 邻异丙基苯酚分子中所有碳原子在同一个平面内
C. 叶蝉散能发生加成、水解反应D. 叶蝉散中不存在手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列![]() 种与人们生产生活相关的有机物:
种与人们生产生活相关的有机物:
①![]() (基础化工原料)②
(基础化工原料)②![]() (防霉剂)③
(防霉剂)③![]() (打火机燃料)④
(打火机燃料)④![]() (冷冻剂)⑤
(冷冻剂)⑤![]() (汽车防冻液)⑥
(汽车防冻液)⑥![]() (杀菌剂)
(杀菌剂)
请回答:
(1)属于醇的是________(填序号)。
(2)与①互为同系物的是________(填序号)。
(3)与③互为同分异构体的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过以下途径合成:
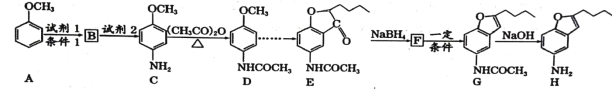
已知:①![]() (苯胺易被氧化)
(苯胺易被氧化)
②甲苯发生一硝基取代反应与A类似。
回答下列问题:
(1)写出化合物H的分子式__________,C中含氧官能团的名称___________。
(2)写出有关反应类型:B![]() C ___________;F
C ___________;F![]() G___________。
G___________。
(3)写出A![]() B的反应方程式:___________________________ 。
B的反应方程式:___________________________ 。
(4)写出同时满足下列条件D的所有同分异构体的结构简式:____________
①能发生银镜反应
②能发生水解反应,水解产物之一与FeCl3溶液反应显紫色
③核磁共振氢谱(1![]() 显示分子中有4种不同化学环境的氢
显示分子中有4种不同化学环境的氢
(5)合成途径中,C转化为D的目的是_____________________。
(6)参照上述合成路线,以甲苯和(CH3CO)2O为原料(无机试剂任选),设计制备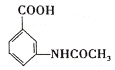 的合成路线:_________________________
的合成路线:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为(a/7+1) NAB.所含原子总数为aNA/14
C.燃烧时消耗的O2一定是33.6 a/14LD.所含碳氢键数目为aNA/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为___________。
(2) 装置B的作用为_______________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为________________________。
(3) 仪器F的名称为_________________,E中冷凝水的入口是___________(填“a”或“b”),F的作用为_______________________________________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为____________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是_____
A.重结晶B.过滤 C.蒸馏D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com