
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
【答案】蒸馏烧瓶 生成FeSO4溶液,且用产生的H2排尽装置内的空气 关闭k2 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 取最后一次洗涤液,加入稀盐酸酸化,再滴入BaCl2溶液,若无白色沉淀,则洗涤干净 隔绝空气 乳酸根离子中的羟基也能被高锰酸钾氧化,导致消耗高锰酸钾溶液用量偏多 蓝色褪去且半分钟不恢复 95.2%
【解析】
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,B制备硫酸亚铁,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。C装置中硫酸亚铁和NH4HCO3发生反应产生FeCO3沉淀。
Ⅱ.Fe2+有较强还原性,易被空气中氧气氧化,获取乳酸亚铁晶体过程中应减小空气中氧气的干扰;①乳酸和亚铁离子都可被酸性高锰酸钾氧化;
②I2的淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,最终褪色;根据已知反应可得关系式2Fe3+~~I2~~2S2O32-,根据滴定时参加反应的硫代硫酸钠的物质的量计算出Fe2+的物质的量,再计算样品纯度。
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,装置B制备硫酸亚铁,C装置中硫酸亚铁和NH4HCO3发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
(1)由仪器图形可知B为蒸馏烧瓶;打开kl、k2,加入适量稀硫酸,可使生成的氢气排出装置C内的空气,防止二价铁被氧化;
(2)待装置内空气排出后,再关闭k2,反应产生的氢气使装置内的气体压强增大,可将B中生成的硫酸亚铁溶液排到装置C中,发生反应生成碳酸亚铁,同时生成二氧化碳,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)FeCO3是从含有SO42-的溶液中过滤出来的,检验沉淀是否洗涤干净,可通过检验是否含有SO42-判断。方法是:取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的BaCl2溶液,若无白色浑浊出现,则表明洗涤液中不存在SO42-,即可判断FeCO3沉淀洗涤干净;
Ⅱ.(4)Fe2+有较强还原性,易被空气中氧气氧化,则乳酸亚铁应隔绝空气,防止被氧化;
(5)①乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,Fe2+也可以被氧化,因此二者反应都消耗KMnO4溶液,导致消耗高锰酸钾的增大,使计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
②I2遇淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,说明I2与Na2S2O3发生了氧化还原反应,当蓝色刚好褪去且半分钟不恢复,即可判断为滴定终点;24.80 mL0.1000mol/L硫代硫酸钠溶液中硫代硫酸钠的物质的量为n(Na2S2O3)=0.02480L×0.100mol/L=2.48×10-3mol,根据关系式2Fe2+~2Fe3+~I2~2S2O32-,可知样品中CH3CH(OH)COO]2Fe3H2O的物质的量为n(Fe2+)=n(S2O32-)=2.48×10-3mol×![]() =9.92×10-3mol,则样品的纯度为
=9.92×10-3mol,则样品的纯度为![]() ×100%=95.2%。
×100%=95.2%。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
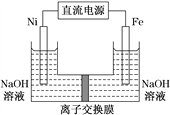
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是( )
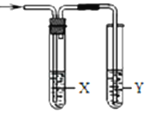
除杂装置 检验装置
生成的气体 | 试剂 | 试剂 | |
| 电石与水反应制取的乙炔 |
|
|
| 木炭与浓 | 饱和 | 澄清石灰水 |
|
| 水 |
|
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:
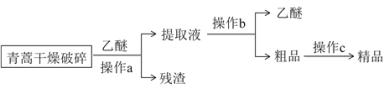
⑴ “破碎”的目的是_______________________________________。
⑵ 操作a和操作b的名称分别是_________、___________。
⑶ 操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷ 操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
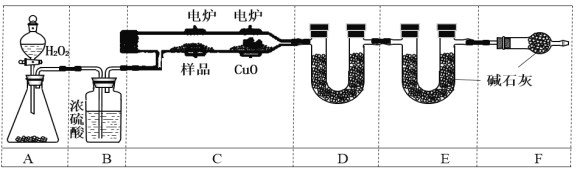
⑸ 实验前至少称量_________个质量数据。
⑹ 装置D中所盛固体可以是____(用对应符号填空);(a.生石灰 b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是_______________________________________。
⑺ A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻ 燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以海水晒盐后所得苦卤(溶质主要含MgCl2,还有NaCl等)为原料制取金属镁的流程如图:
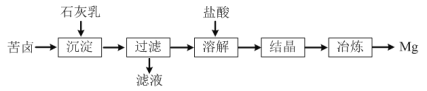
(1)“沉淀”反应的化学方程式为___。
(2)“溶解”反应的离子方程式为___。
(3)工业上冶炼镁时采用的方法是___(填字母)。
a.电解熔融MgCl2
b.用氢气还原MgCl2
c.加热分解MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )
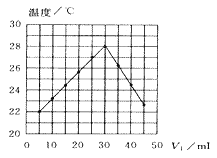
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
A.0.1molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com