
【题目】将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )
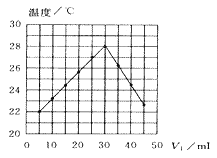
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(![]() 、
、![]() 、
、![]() )与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
)与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
①![]()
②![]()
③![]()
请回答:
(1)依据上述反应,则![]()
![]() ____________
____________![]()
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。下图为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。

①乙炔体积分数在1530K之前随温度升高而增大的原因可能是______________________;1530K之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530K时测得气体的总物质的量为1.000mol,则反应![]() 的平衡常数K=__________________。
的平衡常数K=__________________。
③在恒温条件下,测得上述反应过程在相同时间时不同进料气n(氢气)/n(乙烯)下的乙炔产率﹐请画出乙炔产率随n(氢气)/n(乙烯)的变化关系图。
 ____________
____________
(二)乙炔―空气燃料电池是一种碱性(20%-30%的KOH溶液)的电池,电池放电时,负极的电极方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散是一种新型杀虫剂,防效迅速,且残效不长,对水稻叶蝉和飞虱具有较强的触杀作用。工业上用邻异丙基苯酚合成叶蝉散的过程如下:

邻异丙基苯酚 叶蝉散
下列有关说法不正确的是 ( )
A. 叶蝉散的相对分子质量为193B. 邻异丙基苯酚分子中所有碳原子在同一个平面内
C. 叶蝉散能发生加成、水解反应D. 叶蝉散中不存在手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过以下途径合成:
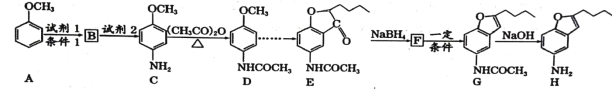
已知:①![]() (苯胺易被氧化)
(苯胺易被氧化)
②甲苯发生一硝基取代反应与A类似。
回答下列问题:
(1)写出化合物H的分子式__________,C中含氧官能团的名称___________。
(2)写出有关反应类型:B![]() C ___________;F
C ___________;F![]() G___________。
G___________。
(3)写出A![]() B的反应方程式:___________________________ 。
B的反应方程式:___________________________ 。
(4)写出同时满足下列条件D的所有同分异构体的结构简式:____________
①能发生银镜反应
②能发生水解反应,水解产物之一与FeCl3溶液反应显紫色
③核磁共振氢谱(1![]() 显示分子中有4种不同化学环境的氢
显示分子中有4种不同化学环境的氢
(5)合成途径中,C转化为D的目的是_____________________。
(6)参照上述合成路线,以甲苯和(CH3CO)2O为原料(无机试剂任选),设计制备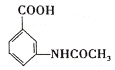 的合成路线:_________________________
的合成路线:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.S![]() SO3
SO3![]() H2SO4B.Al2O3
H2SO4B.Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
C.SiO2 ![]() SiCl4
SiCl4![]() SiD.Fe2O3
SiD.Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为(a/7+1) NAB.所含原子总数为aNA/14
C.燃烧时消耗的O2一定是33.6 a/14LD.所含碳氢键数目为aNA/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com