
【题目】下列物质的转化在给定条件下能实现的是( )
A.S![]() SO3
SO3![]() H2SO4B.Al2O3
H2SO4B.Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
C.SiO2 ![]() SiCl4
SiCl4![]() SiD.Fe2O3
SiD.Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
【答案】B
【解析】
A.S点燃条件下与O2反应不能生成SO3;
B.Al2O3和NaOH溶液反应生成NaAlO2,NaAlO2溶液中通入CO2,生成Al(OH)3沉淀;
C.SiO2一般情况下不与酸反应;
D.FeCl3溶液会发生Fe3+的水解;
A.S点燃条件下与空气或纯O2反应只能生成SO2,不能生成SO3,故A错误;
B.氧化铝和氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液中通入二氧化碳,发生反应NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,所以能实现,故B正确;
C.SiO2与盐酸溶液不发生,故C错误;
D.FeCl3溶液在加热时会促进Fe3+的水解:FeCl3+3H2O=Fe(OH)3+3HCl,最终得不到无水FeCl3,故D错误;
故答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
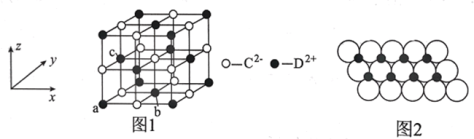
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以海水晒盐后所得苦卤(溶质主要含MgCl2,还有NaCl等)为原料制取金属镁的流程如图:
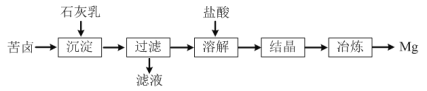
(1)“沉淀”反应的化学方程式为___。
(2)“溶解”反应的离子方程式为___。
(3)工业上冶炼镁时采用的方法是___(填字母)。
a.电解熔融MgCl2
b.用氢气还原MgCl2
c.加热分解MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )
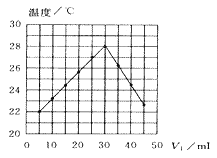
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是
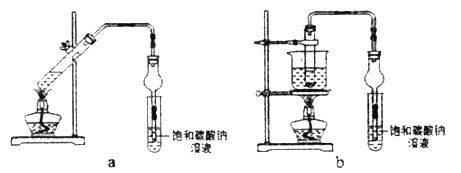
A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
A.0.1molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.观察Fe(OH)2的生成
B.配制一定物质的量浓度的NaCO3溶液
C.除去CO中的CO2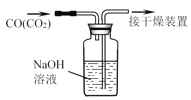
D.实验室模拟制备NaHCO3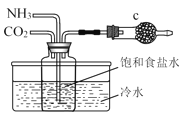
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
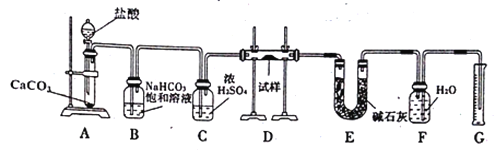
回答下列问题:
(1)实验前必须先_______________________________________________。
(2)装置B的作用是_____________;装置E的作用是______________;
(3)装置D中发生氧化还原反应的化学方程式是:__________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com