
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
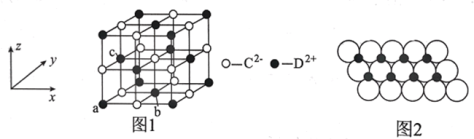
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
【答案】![]() 哑铃形(或纺锤形) O>N>As < 分子晶体 (0,
哑铃形(或纺锤形) O>N>As < 分子晶体 (0,![]() ,
,![]() )
) ![]()
【解析】
根据元素核外电子排布规律分析元素的种类;根据元素周期律比较电负性大小;根据晶体的性质判断晶体类型;根据晶胞的结构进行相关计算。
基态A原子的价电子排布式为nsnnpn,则A的价电子排布式为2s22p2,A为C元素;C原子基态时2p能级上有2个未成对的电子,则C为氧元素,因为A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,则B为氮元素;D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,则D原子3d轨道上电子数目为8,则D为28号元素镍;B与E同主族,则E为砷;
(1)基态碳原子的价电子轨道表示式为![]() ;其电子占据的最高能级为2p能级,p轨道的电子云形状为:哑铃形(或纺锤形);
;其电子占据的最高能级为2p能级,p轨道的电子云形状为:哑铃形(或纺锤形);
(2)非金属性越强电负性越强,同周期元素核电荷数越大电负性越大,故电负性:O>N,同主族元素核电荷数越小电负性越大,故电负性:N>As,故答案为:O>N>As;
(3)相同非金属元素对应的含氧酸中,元素化合价越高,酸性越强,则二者酸性强弱H3EO3<H3EO4;
(4)该配合物为无色挥发性液态,说明熔沸点较低,构成晶体的微粒间以范德华力结合,则该配合物的晶体类型是分子晶体;
(5)根据图示坐标轴的方向,a为原点,坐标参数为(0,0,0),则b的坐标参数为(![]() ,
,![]() ,0),则c离子的坐标参数为(0,
,0),则c离子的坐标参数为(0,![]() ,
,![]() );图中单层分子可以如图画出一维重复单元:
);图中单层分子可以如图画出一维重复单元: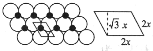 重复单元呈平行四边形,所占面积,S=2x×
重复单元呈平行四边形,所占面积,S=2x×![]() x=
x=![]() m2,每个重复单元包含1个O原子和1个Ni原子,则1m2上该晶体的质量为
m2,每个重复单元包含1个O原子和1个Ni原子,则1m2上该晶体的质量为![]() g。
g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】溶液A中可能含有如下离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学设计并完成了如下的实验:
。某同学设计并完成了如下的实验:
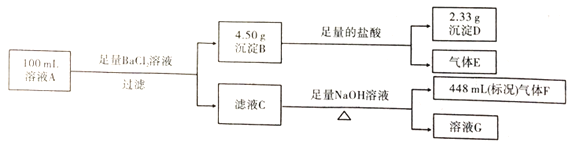
下列说法正确的是
A.气体F能使湿润的蓝色石蕊试纸变红
B.溶液A中一定存在![]() 、
、![]() 、
、![]() ,可 能存在
,可 能存在![]()
C.溶液A中一定存在![]() 、
、![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]()
D.溶液A中可能存在![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)大理石与盐酸反应___________
(2)二氧化碳通人足量澄清石灰水中___________
(3)小苏打(NaHCO3)与盐酸反应_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.![]() 属于有机物,因此是非电解质
属于有机物,因此是非电解质
B.石油裂化和裂解的目的均是为了将长链烃转化为短链烃
C.煤的气化,液化和干馏都是化学变化
D.等质量的乙烯,丙烯分别充分燃烧,所耗氧气的物质的量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(![]() 、
、![]() 、
、![]() )与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
)与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
①![]()
②![]()
③![]()
请回答:
(1)依据上述反应,则![]()
![]() ____________
____________![]()
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。下图为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。

①乙炔体积分数在1530K之前随温度升高而增大的原因可能是______________________;1530K之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530K时测得气体的总物质的量为1.000mol,则反应![]() 的平衡常数K=__________________。
的平衡常数K=__________________。
③在恒温条件下,测得上述反应过程在相同时间时不同进料气n(氢气)/n(乙烯)下的乙炔产率﹐请画出乙炔产率随n(氢气)/n(乙烯)的变化关系图。
 ____________
____________
(二)乙炔―空气燃料电池是一种碱性(20%-30%的KOH溶液)的电池,电池放电时,负极的电极方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备![]() 和
和![]() 的流程如图所示:
的流程如图所示:
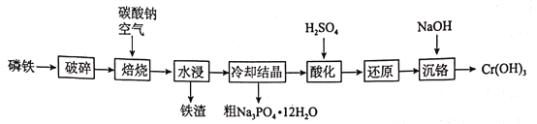
已知:水浸后溶液的主要成分为![]() 和
和![]() ;
;![]() 的
的![]() 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________。
(2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。
(3)进一步提纯粗磷酸钠晶体的方法为________________。
(4)“酸化”时发生反应的离子方程式为________________________________________________。
(5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知:![]() ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物名称正确的是( )
A. ![]() 2-乙基丙烷B.
2-乙基丙烷B. ![]() 间二甲苯
间二甲苯
C. CH3CH2CH2CH2OH 1-羟基丁烷D. CH3-CH=CH2 2-甲基-2-丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑦在表中的位置,用化学用语回答下列问题:
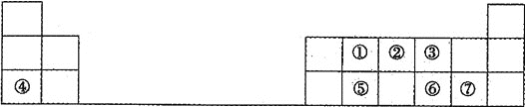
(1)①在周期表中的位置是__,②、⑤原子半径的大小关系为__(填元素符号)。
(2)①、⑤、⑦的最高价含氧酸的酸性由强到弱的顺序是__(填化学式)。
(3)③和⑥的气态氢化物稳定性强弱关系__(填化学式)。
(4)④和⑦两种单质形成的化合物含有的化学键__(填“共价键”或“离子键”),③和⑥两种单质反应的化学方程式__。
(5)②的最简单氢化物与其最高价氧化物对应水化物反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.S![]() SO3
SO3![]() H2SO4B.Al2O3
H2SO4B.Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
C.SiO2 ![]() SiCl4
SiCl4![]() SiD.Fe2O3
SiD.Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com