
【题目】写出下列反应的离子方程式:
(1)大理石与盐酸反应___________
(2)二氧化碳通人足量澄清石灰水中___________
(3)小苏打(NaHCO3)与盐酸反应_________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学在实验室模拟用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝 [A12(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究,相关过程如下:
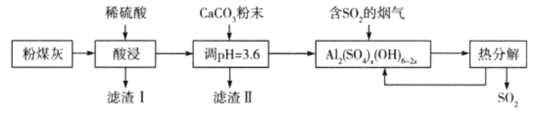
下列说法错误的是
A.滤渣I、II的主要成分分别为SiO2、CaSO4
B.若将pH调为4,则可能导致溶液中铝元素的含量降低
C.吸收烟气后的溶液中含有的离子多于5种
D.完全热分解放出的SO2量等于吸收的SO2量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化钛制金属钛,主要反应有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2![]() TiCl4↑+CO↑
TiCl4↑+CO↑
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是( )
A. 反应①属于非氧化还原反应
B. 反应②是水解反应
C. 反应④中二氧化钛是氧化剂
D. 反应⑤表现了金属镁还原性比金属钛强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH≡CCH(CH3)2系统命名法命名为 。
(2) 2,3-二甲基-1-丁烯的结构简式为 。
(3)支链只有一个乙基且式量最小的烷烃的结构简式为 。
(4)某烃分子式为C6H14,若该烃不可能由炔烃与氢气加成得到则该烃的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL![]()
![]() 溶液中逐滴加入20mL
溶液中逐滴加入20mL![]() 的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
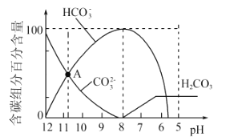
A.HCl溶液滴加一半时:![]()
B.在A点:![]()
C.当![]() 时:
时:![]()
D.当![]() 时,溶液中
时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中含有的可溶性杂质硫酸盐、氯化钙和氯化镁,某同学利用给定试剂NaOH溶液、BaCl2溶液、Na2CO3溶液和盐酸,设计了如下实验流程:
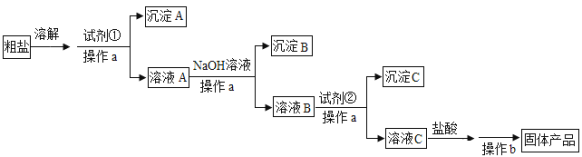
请回答:
(1)操作a和操作b的名称依次是______。
(2)试剂①是______。
(3)加入NaOH后,发生反应的离子方程式是___________。
(4)加入试剂②后,发生反应的离子方程式是___________。
(5)加入盐酸的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
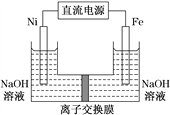
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
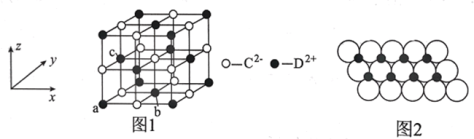
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com