
【题目】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备![]() 和
和![]() 的流程如图所示:
的流程如图所示:
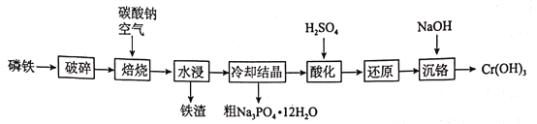
已知:水浸后溶液的主要成分为![]() 和
和![]() ;
;![]() 的
的![]() 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________。
(2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。
(3)进一步提纯粗磷酸钠晶体的方法为________________。
(4)“酸化”时发生反应的离子方程式为________________________________________________。
(5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知:![]() ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
【答案】增大反应物的接触面积,提高培烧速率,使焙烧更充分 钢制 ![]() ,腐蚀陶瓷坩埚
,腐蚀陶瓷坩埚 ![]() 重结晶
重结晶 ![]() 5.48
5.48
【解析】
将磷铁(含P、Fe、Cr等)粉碎后和碳酸钠混合并在空气中焙烧,用水溶解过滤除去铁渣,水浸液的主要成分为![]() 和
和![]() ,将水浸液蒸发浓缩并冷却结晶,过滤后即得到Na3PO412H2O的粗产品,滤液用稀硫酸酸化后,继续还原得到Cr3+的溶液,再加入NaOH调节溶液的pH,即可得到Cr(OH)3沉淀,再经过过滤操作即得产品,据此分析解题。
,将水浸液蒸发浓缩并冷却结晶,过滤后即得到Na3PO412H2O的粗产品,滤液用稀硫酸酸化后,继续还原得到Cr3+的溶液,再加入NaOH调节溶液的pH,即可得到Cr(OH)3沉淀,再经过过滤操作即得产品,据此分析解题。
(1)焙烧前先将磷铁粉碎,可增大反应物的接触面积,达到提高培烧速率,使焙烧更充分的目的;
(2)因高温下碳酸钠和SiO2能反应生成硅酸钠和CO2,陶瓷中含有SiO2,则“焙烧”磷铁和碳酸钠混合物时,应将原料加到铁制坩埚中,可防止发生反应:![]() ,避免腐蚀陶瓷坩埚;焙烧时Cr单质和Na2CO3在氧气中发生反应生成Na2CrO4和CO2,发生的主要反应的化学方程式为
,避免腐蚀陶瓷坩埚;焙烧时Cr单质和Na2CO3在氧气中发生反应生成Na2CrO4和CO2,发生的主要反应的化学方程式为![]() ;
;
(3)粗磷酸钠晶体混有![]() ,可结合两者的溶解度随温度变化情况,可通过重结晶提纯得到精制的磷酸钠晶体;
,可结合两者的溶解度随温度变化情况,可通过重结晶提纯得到精制的磷酸钠晶体;
(4)将![]() 溶液“酸化”得到Na2Cr2O7,发生反应的离子方程式为
溶液“酸化”得到Na2Cr2O7,发生反应的离子方程式为![]() ;
;
(5)已知Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=2.7×10-31,当c(Cr3+)=10-5mol/L,c(OH-)=![]() mol/L=3×10-9 mol/L,此时溶液的pH=14-9+lg3=5.48。
mol/L=3×10-9 mol/L,此时溶液的pH=14-9+lg3=5.48。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为![]() 的具有漂白性的物质,工业上常用电解饱和
的具有漂白性的物质,工业上常用电解饱和![]() 溶液来获得Z的单质及其他产品。下列说法正确的是( )
溶液来获得Z的单质及其他产品。下列说法正确的是( )
A.W和X 、Y 、Z均能形成18电子的分子
B.X 、Y 之间形成的化合物可能同时含有离子键和非极性共价健
C.上述四种元素的原子半径大小顺序为![]()
D.W、X 、Z三种元素形成的化合物一定是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
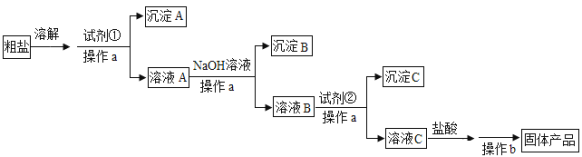
【题目】为除去粗盐中含有的可溶性杂质硫酸盐、氯化钙和氯化镁,某同学利用给定试剂NaOH溶液、BaCl2溶液、Na2CO3溶液和盐酸,设计了如下实验流程:
请回答:
(1)操作a和操作b的名称依次是______。
(2)试剂①是______。
(3)加入NaOH后,发生反应的离子方程式是___________。
(4)加入试剂②后,发生反应的离子方程式是___________。
(5)加入盐酸的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示代表周期表中的几种短周期元素,下列说法中错误的是()
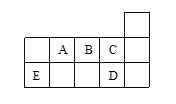
A. ED4分子中各原子均满足8电子稳定结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. C、D气态氢化物稳定性强弱为C>D
D. A、B、C电负性大小顺序为C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
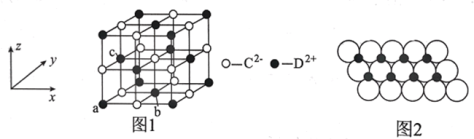
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物(a)![]() 、(b)
、(b)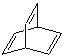 、(c)
、(c)![]() ,(d)
,(d)![]() ,下列说法不正确的是 ( )
,下列说法不正确的是 ( )
A. a、b、c、d互为同分异构体B. 除a外均可发生加成反应
C. c中所有原子不可能处于同一平面D. 一氯代物同分异构体最多的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扎来普隆是一种短期治疗失眠症的药物,其合成路线如下:

回答下列问题:
(1)A中的官能团名称是________________。
(2)![]() 所需的试剂和条件分别为________________。
所需的试剂和条件分别为________________。
(3)![]() 、
、![]() 的反应类型依次为________、________。
的反应类型依次为________、________。
(4)扎来普隆的分子式为________________。
(5)![]() 的化学方程式为________________________。
的化学方程式为________________________。
(6)属于芳香化合物,且含有硝基,并能发生银镜反应的B的同分异构体有________种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式有________________。
(7)已知:![]() 有碱性且易被氧化。设计由
有碱性且易被氧化。设计由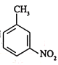 和乙醇制备
和乙醇制备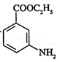 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是
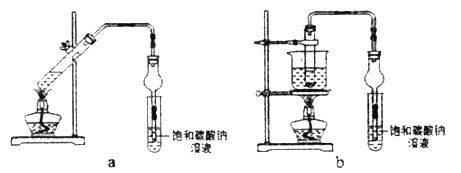
A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com