
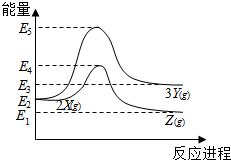
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
分析 由图象可知2X(g)≒3Y(g)为吸热反应,而2X(g)≒2Z(g)为放热反应,反应热等于反应物的总能量-生成物的总能量,结合温度、压强对平衡移动的影响解答该题.
解答 解:A.根据化学反应的实质,由X→Y反应的△H=E3-E2,故A错误;
B.由图象可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即由反应的△H<0,故B正确;
C.根据化学反应2X(g)≒3Y(g),该反应是气体系数和增加的可逆反应,降低压强,平衡正向移动,有利于提高Y的产率,故C正确;
D.由B分析可知,该反应为放热反应,升高温度,平衡逆向移动,Z的产率降低,故D错误.
故选BC.
点评 本题考查了化学反应中能量的变化图,为2016年海南高考题,侧重于学生的分析能力的考查,注意把握图象的分析,注意根据反应物的总能量与生成物的总能量进行比较,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH216O和20gH218O含有的质子数均为10NA | |
| B. | 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2═2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
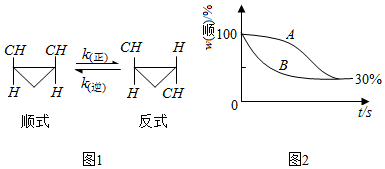
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
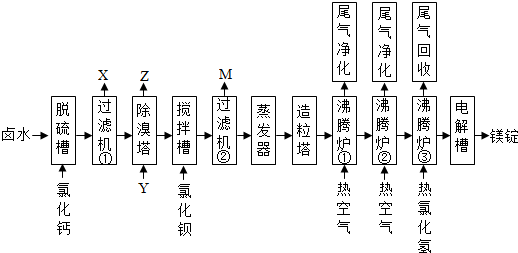
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
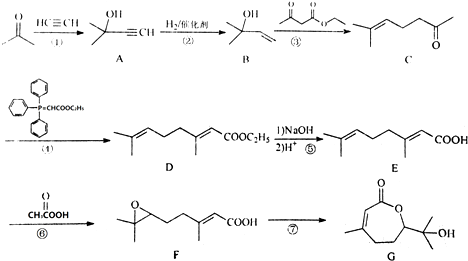
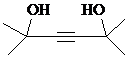 .
.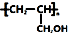 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com