
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
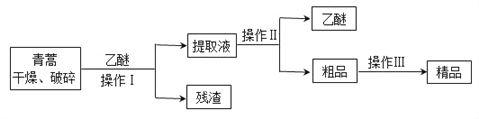
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是____________________。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、漏斗、_______,操作Ⅱ的名称是_______。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.20g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
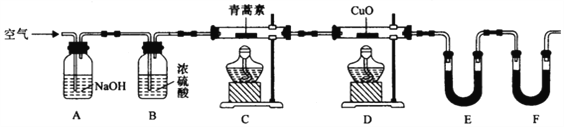
①装置E,F中盛放的物质分别是__________,____________。
②用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
③该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______。
【答案】 増大接触面积 提高浸取率 玻璃棒 蒸馏 B 无水CaCl2/H2SiO3 /硅胶 NaOH溶液/碱石灰 C15H22O5 在F后加一个装碱石灰的U形管
【解析】分析:(1)根据外界条件对反应速率的影响分析;
(2)根据操作I为过滤分析选择玻璃仪器;提取液经过蒸馏后可得青蒿素的粗品;
(3)根据青蒿素易溶于乙醇,在水中几乎不溶分析;
(4)为了能准确测量青蒿素燃烧生成的CO2和H2O,实验前应通入除去CO2和H2O的空气,排除装置内的空气,防止干扰实验,所以装置A中应装有NaOH溶液,E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的为CaCl2或P2O5,而F中为碱石灰,据此答题。
详解:根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品。则
(1)根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)根据上面的分析可知,操作I为过滤,需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,操作Ⅱ的名称是蒸馏;
(3)根据上面的分析可知,装置A中盛放的物质是NaOH溶液,粗品中加95%的乙醇,浓缩、结晶、过滤可得精品,答案选B;
(4)①根据上面的分析可知,E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的为CaCl2或P2O5,而F中为碱石灰;
②由表中数据可知m(H2O)=42.4g-22.6g=19.8g,所以n(H2O)=19.8g÷18g/mol=1.1mol。m(CO2)=146.2g-80.2g=66g,所以n(CO2)=66g÷44g/mol=1.5mol,所以青蒿素中氧原子的质量为m(O)=28.20g-2.2g-1.5mol×12g/mol=8g,所以n(O)=0.5mol,则N(C):N(H):N(O)=1.5:2.2:0.5=15:22:5,所以最简式为C15H22O5;
③由于空气中也含有水蒸气和二氧化碳,所以该实验装置可能会产生误差,造成测定含氧量偏低,因此改进方法是在F后加一个装碱石灰的U形管。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素![]() )等。每100克黑木耳含铁高达185毫克。
)等。每100克黑木耳含铁高达185毫克。
ii.紫色的![]() 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的![]() 。
。
I:为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
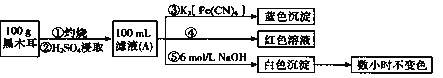
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验![]() 所用试剂是_________溶液。
所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_____(填字母符号)。
a.黑木耳中一定含![]() 和
和![]()
b.滤液A中一定含![]() 和
和![]()
c.白色沉淀中一定含![]()
II:为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
![]()
(4)可选作试剂B的物质是__________(填字母序号)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是____________。
(6)若同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______.
(2)W与Y可形成化合物W2Y,该化合物的电子式为______.
(3)Y在周期表中的位置是______.
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同):______;比较Y、Z的气态氢化物稳定性强弱:______>______.
(5)X的硝酸盐水溶液显______性,用离子方程式解释原:______.
(6)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:______.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:______.
(8)以N2、H2 为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。
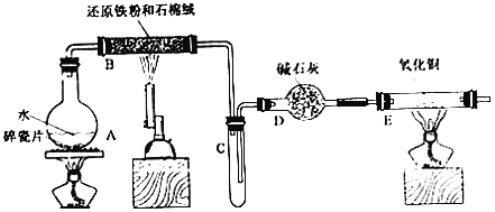
(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com