
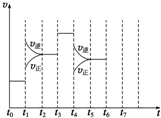
 在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: ,故答案为:
,故答案为: ;
;| 2x |
| a+b-2x |
| a+b-2x |
| a+b |
| 12x-2x |
| 12x |
| 5 |
| 6 |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| A、① | B、②③④ |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3种 |
| B、用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① |
| C、反应②中加入过量的NaHCO3有利提高阿司匹林的产率 |
| D、1mol阿司匹林最多可以和2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氮、磷化合物的生活污水大量排放可使水体富营养化,造成潮汐 |
| B、各国工业大量排放二氧化硫是全球气候变暖的主要原因 |
| C、劣质装修材料中的甲醛、苯、氡气等对人体有害 |
| D、废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
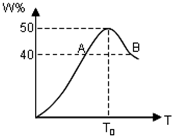 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:. |
| v |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl- |
| B、SO42- |
| C、OH- |
| D、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com