
【题目】化学与生活密切相关,下列说法正确的是( )
A. 工业用Cl2与澄清石灰水反应制取漂白粉
B. 天然纤维与合成纤维的主要成分都是纤维素
C. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. Na可用于冶炼金属钛
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。回答下列问题:
(1)二氧化硫的制备

①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→ ____________。(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。

①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0 .10 mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中少量杂质的方法正确的是
A. 除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B. 除去NO2中混有的NO:用水洗气
C. 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D. 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
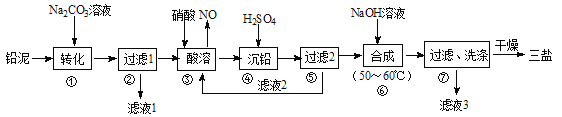
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。

(1)步骤①转化的目的是_______,滤液1中的溶质为Na2CO3和_______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质的化学式为_______。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________。
(5)步骤⑥合成三盐的化学方程式为____________,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器中的气体一定具有相同的( )
A.原子数 B.密度 C.质量 D.H的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较多的CuSO4和少量的Fe2(SO4)3。若用该溶液制取硫酸铜固体;可供选择的操作有:
(1)加适量H2SO4溶液;(2)加适量CuO;(3)冷却结晶;(4)加过量NaOH;(5)加强热至有大量白色固体析出;(6)过滤。正确的操作步骤是( )
A. (2)(6)(3)(6) B. (4)(6)(1)(3) C. (4)(6)(3)(5) D. (2)(6)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是______(用元素符号表示)。
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为______。
(4)元素⑤与元素⑧形成的化合物的电子式为________。
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填酸的化学式)。
(6)⑤⑥两元素相比较,金属性较强的是________ (填名称),可以验证该结论的实验是_____(填字母)。
A、将在空气中放置已久的这两种元素的块状单质分别放入热水中
B、将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C、将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D、比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com