
【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是______(用元素符号表示)。
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为______。
(4)元素⑤与元素⑧形成的化合物的电子式为________。
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填酸的化学式)。
(6)⑤⑥两元素相比较,金属性较强的是________ (填名称),可以验证该结论的实验是_____(填字母)。
A、将在空气中放置已久的这两种元素的块状单质分别放入热水中
B、将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C、将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D、比较这两种元素的气态氢化物的稳定性
【答案】  S>Cl>F Al(OH )3+OH-= AlO2-+2H2O
S>Cl>F Al(OH )3+OH-= AlO2-+2H2O ![]() HClO4 镁 BC
HClO4 镁 BC
【解析】试题分析:(1)最外层有2个或8个电子的结构稳定;(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小;(3)氢氧化铝是两性氢氧化物,氢氧化钠与氢氧化铝反应生成偏铝酸钠;(4)MgCl2是离子化合物;(5)非金属性越强,最高价含氧酸酸性越强;(6)同周期元素从左到右金属性减弱。
解析:根据以上分析,(1)最外层有2个或8个电子的结构稳定,表中化学性质最不活泼的元素是18号元素Ar,其原子结构示意图为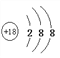 ;(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小,元素F、S、Cl中,原子半径从大到小的顺序是S>Cl>F;(3)氢氧化铝是两性氢氧化物,氢氧化钠与氢氧化铝反应生成偏铝酸钠,反应的离子方程式是Al(OH )3+OH-= AlO2-+2H2O;(4)MgCl2是离子化合物,电子式为
;(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小,元素F、S、Cl中,原子半径从大到小的顺序是S>Cl>F;(3)氢氧化铝是两性氢氧化物,氢氧化钠与氢氧化铝反应生成偏铝酸钠,反应的离子方程式是Al(OH )3+OH-= AlO2-+2H2O;(4)MgCl2是离子化合物,电子式为![]() ;(5)氯元素非金属性强,最高价含氧酸酸性越强的是HClO4;(6)同周期元素从左到右金属性减弱,镁的金属性大于铝;A.将在空气中放置已久的这两种元素的块状单质分别放入热水中,都生成氧化膜,不能证明金属性强弱,故A错误;
;(5)氯元素非金属性强,最高价含氧酸酸性越强的是HClO4;(6)同周期元素从左到右金属性减弱,镁的金属性大于铝;A.将在空气中放置已久的这两种元素的块状单质分别放入热水中,都生成氧化膜,不能证明金属性强弱,故A错误;
B、.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,镁反应快,可证明镁的金属性大于铝,故B正确;
C、.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,镁与热水反应生成氢氧化镁和氢气,能证明镁的金属性大于铝,故C正确;
D、金属不能比较氢化物的稳定性,故D错误。


科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,下列有关说法正确的是

(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
A. a电极反应式为2H++2e-===H2↑
B. 产物丙为硫酸
C. d为阴离子交换膜
D. Na2SO4溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2)通常用作分析试剂、氧化剂、漂白剂等。制备反应原理为:Sr+O2![]() SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。

(1)选择必要仪器组装制备过氧化锶(气流按从左到右的流向):____________(填字母)。
(2)该实验制备氧气的化学方程式为______________。
(3)连接好装置并进行实验,实验步骤如下,实验操作顺序为___________(填字母)。
①打开分液漏斗活塞,将水滴入烧瓶②在相应装置中装入药品③检查装置气密性④加热
⑤停止加热⑥关闭分液漏斗活塞
(4)利用反应Sr2++H2O2+2NH3+8H2O=SrO2·8H2O↓+2NH4+,制备过氧化锶的装置如下:

①X仪器的作用是_____________。
②氨气在该反应所起的作用是__________________。
③实验结束后,得到SrO2·8H2O的操作为_________________。
(5)设计实验证明SrO2的氧化性比FeCl3的氧化性强__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A. 工业用Cl2与澄清石灰水反应制取漂白粉
B. 天然纤维与合成纤维的主要成分都是纤维素
C. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. Na可用于冶炼金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 环己烷与苯可用酸性KMnO4溶液鉴别
D. 水可以用来分离溴苯和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.强酸跟强碱的反应热一定是中和热
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
C.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
D.表示中和热的离子方程式为H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3kJ/mol
H2O(l) ΔH=-57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

(1) 若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e,S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol -1,则S8分子硫硫键的键能为 kJ·mol-1
(2)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2分子的体积分数不小于 (用百分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴周期表第四周期第Ⅷ族元素,其化合物用途广泛,如:LiCoO2做锂电池的正极材料;草酸钴可用于指示剂和催化剂制备。
Ⅰ.(1)LiCoO2中钴元素的化合价为_______
(2)工业上将废锂电池的正极材料与过氧化氢溶液,稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为:______________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是____________
Ⅱ.利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(3)浸出液中加NaClO3的目的是:______________.
(4)请用平衡移动原理说明加Na2CO3调pH至5.2所得沉淀的原因:____________
(5)滤液Ⅱ中加入萃取剂的作用是___________
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com