
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
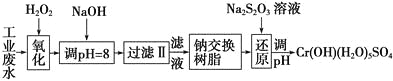
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2B.HNO3C.FeCl3D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水:
的废水:
该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O![]() 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5mol·L-1。
【答案】A AB CD 3S2O32-+4Cr2O![]() +26H+===6SO42-+8Cr3++13H2O 不能 因阳极产生的Cu2+不能使Cr2O
+26H+===6SO42-+8Cr3++13H2O 不能 因阳极产生的Cu2+不能使Cr2O![]() 还原到低价态 Cr2O
还原到低价态 Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O 5
+6Fe2++14H+===2Cr3++6Fe3++7H2O 5
【解析】
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+,被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4。
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故选A项。
综上所述,本题正确答案为A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+、被除去,故选AB项。
综上所述,本题正确答案为AB。
通过钠离子交换树脂,除去Ca2+和Mg2+,故选CD项。
综上所述,本题正确答案为CD。
(3)根据氧化还原反应规律,还原过程中,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,则1mol Cr2O
转移4.8 mol e-,则1mol Cr2O![]() 转移6 mol e-,该反应离子方程式为3S2O32-+4 Cr2O
转移6 mol e-,该反应离子方程式为3S2O32-+4 Cr2O![]() +26H+===6SO42-+8Cr3++13H2O;
+26H+===6SO42-+8Cr3++13H2O;
综上所述,本题正确答案为3S2O32-+4Cr2O![]() +26H+===6SO42-+8Cr3++13H2O;
+26H+===6SO42-+8Cr3++13H2O;
Ⅱ.(1)根据题意,电解时能否用Cu电极来代替Fe电极,铜失电子变为铜离子,不能把Cr2O![]() 还原到低价态;
还原到低价态;
综上所述,本题正确答案:不能,因阳极产生的Cu2+不能使Cr2O![]() 还原到低价态;
还原到低价态;
(2)根据上述分析,电解时阳极的电极反应式为Fe-2e-=Fe2+;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
综上所述,本题正确答案:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)= ![]() =10-9mol/L,c(H+)=10-14/10-9=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5。
=10-9mol/L,c(H+)=10-14/10-9=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5。
综上所述,本题正确答案:5。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:

根据以上信息和相关知识判断,下列分析不正确的是
A.该“84消毒液”的物质的量浓度约为4.0mol·L-1
B.一瓶该“84消毒液”能吸收空气中44.8L的CO2(标准状况)而完全变质
C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含25% NaClO的消毒液,需要称量的NaClO固体质量为149g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的污水中含有FeSO4、CuSO4两种物质。甲、乙、丙三位学生分别设计了从该污水中回收纯净金属铜的方案(如图所示)。
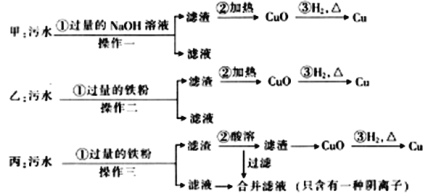
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
甲___,乙___,丙___。(填“能”或“不能”)
(2)在丙同学进行的“酸溶”操作中,加入的酸是___(填“稀盐酸”或“稀硫酸“)。合并的滤液中的主要溶质是___。
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为___。
(4)操作一、二、三的名称是___,该操作中需使用的玻璃仪器有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是____________________________________________。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是______________。
(3)化合物FD3是棕色固体、易潮解、100 ℃左右时升华,它的晶体类型是______________;化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是____________________。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是______________________________________________________________。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的![]() (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确且能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 配制FeCl3溶液 | 将FeCl3固体溶解于适量蒸馏水 |
B | 称取2.0gNaOH 固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g 砝码,左盘上添加NaOH 固体 |
C | 检验溶液中是否含有NH4+ | 取少最试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. NH4++H2O=NH3·H2O+H+
B. Na2SO3+2H2O![]() 2NaOH+2H2SO3
2NaOH+2H2SO3
C. BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
D. NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32-
Ba2++CO32-
B. 向酸性KI溶液中通入臭氧(O3)的离子方程式: 2I-+O3+H2O=I2+O2+2OH-
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:FeCl3+3H2O![]() Fe(OH)3↓+3HCl↑
Fe(OH)3↓+3HCl↑
D. 向Ba(OH)2溶液中滴入NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH-+SO42-+H+=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com