
【题目】实现下列变化时,需克服相同类型作用力的是( )
A. 纯碱和烧碱的熔化 B. 食盐和冰醋酸熔化
C. 液溴和水晶的气化 D. 金刚石和干冰的熔化
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4molL-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.体积相同、浓度均为0.1 mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1
C.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中c(H+)之比为2∶1
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=![]() 。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氢氧化钠溶液
C.若甲为Fe,则丁可能是浓盐酸
D.若甲为AgNO3溶液,则丁可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、MgSO4形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为
A.0.15mol/L B.0.20mol/L C.0.25mol/L D.0.40mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50mL某未知浓度的AlCl3溶液分别加到60mL1molL-1的NaOH溶液或60mL3molL-1的NaOH溶液中,均能得到1.56gAl(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A.1molL-1 B.0.5molL-1 C.0.6molL-1 D.0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列方程式:
(1)乙酸和乙醇的酯化反应方程式
(2)工业冶炼镁的化学方程式
(3)二氧化硅与氢氟酸化学方程式
(4)Na2SO3与FeCl3反应的离子方程式
(5)火法炼铜化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。查阅资料知:Br2的沸点为58.8℃,密度为3.119g·cm-3微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈 态,保存时通常在盛溴的试剂瓶中加入少量 。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
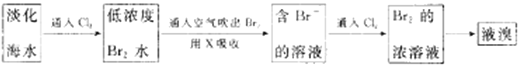
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴
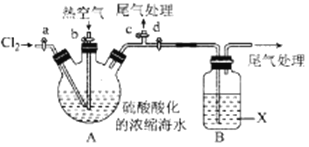
实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现 (实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是 (填序号),尾气处理选用 (填序号)。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为 。
(4)蒸馏时应该选择 ,操作中应控制的关键实验条件为 。
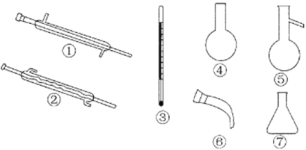
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人们即将步人“5G”时代时,以光导纤维为基础的高速信息通道尤为重要。制造光导纤维的材料是
A. 铜合金 B. 橡胶 C. 聚乙烯 D. 二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com