
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
【答案】C
【解析】
试题分析:A.根据方程式可知该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c2(CH3OH),A错误;B.此时浓度熵Q=![]() <400,因此反应向正反应方向进行,则正、逆反应速率的大小:v正>v逆,B错误;C. 2CH3OH(g)
<400,因此反应向正反应方向进行,则正、逆反应速率的大小:v正>v逆,B错误;C. 2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 0.44 0.6 0.6
转化浓度(mol/L) 2x x x
平衡浓度(mol/L) 0.44-2x 0.6+x 0.6+x
则![]() ,解得x=0.2,所以若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1,C正确;D.根据C中分析可知0~10min内平均反应速率v(CH3OH)=0.4mol/L÷10min=0.04 mol·(L·min)-1,D错误,答案选C。
,解得x=0.2,所以若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1,C正确;D.根据C中分析可知0~10min内平均反应速率v(CH3OH)=0.4mol/L÷10min=0.04 mol·(L·min)-1,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
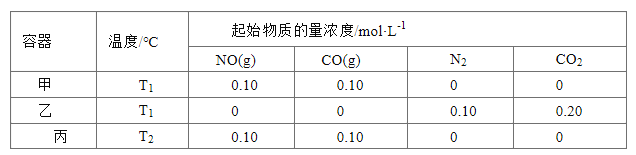
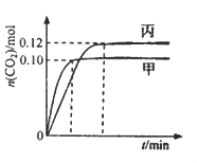
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率小于50%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某一元弱酸(HA)和氢氧化钠溶液混合后溶液呈中性,则此溶液中c(Na+)与c(A-)的关系为( )
A. c(Na+)=c(A-) B. c(Na+)<c(A-) C. c(Na+)>c(A-) D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是

A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析以下说法:①粗盐和矿泉水都是混合物;②氨水和NaOH都是电解质;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和烟、雾都是胶体。上述说法正确的是( )
A.①②③④ B.①②④⑥ C.①③④⑦ D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
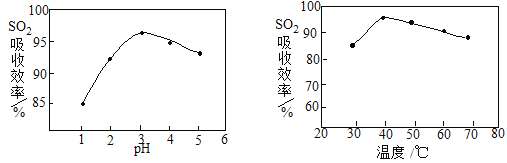
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质是( )
A.胶体粒子带电荷并且在一定条件下能稳定存在
B.胶体粒子不能穿过半透膜,能通过滤纸空隙
C.胶体的分散质粒子直径在1nm~100nm之间
D.胶体粒子能够发生布朗运动而且能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯可用作食用香料。某小组用如下装置制备苯甲酸乙酯
反应原理: (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如下:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
熔点/℃ | 122.1 | -117.3 | -34.6 |
沸点/℃ | 249 | 78.3 | 213 |

实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品。
回答下列问题:
(1)仪器C的名称______________。
(2)步骤① 若加热后才发现未加沸石,应采取的措施是________;步骤② 采取水浴加热的优点是______。
(3)步骤③ 为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是____________。
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有__________,使用该仪器之前需要进行的操作是__________;无水MgSO4的作用是___________。
(5)步骤⑤收集馏分应控制的最佳温度为____________。
(6)为了提高苯甲酸乙酯的产率,可以采取的措施_________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L﹣1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A.该混合溶液pH=7.0
B.原HA溶液中:c(HA)>c(H+)>c(A﹣)
C.图中X表示HA,Y表示OH﹣,Z表示H+
D.混合溶液中:c(X)+x(A﹣)=c(K+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com