
分析 A、B、W、D、E为短周期元素,且原子序数依次增大,E元素的周期序数与主族序数相等,结合原子序数可知,E只能处于第三周期,故E为Al;D、E同周期,处于第三周期,结合原子序数可知D处于ⅠA族或ⅡA族,而A、D同主族,A、W能形成两种液态化合物A2W和A2W2,A应为H、W为O、D为Na,B的原子序数=40-1-8-11-13=7,则B为N元素,
(1)铝离子水解生成氢氧化铝胶体,吸附悬浮物质;
(2)H2O2分子中含有为极性共价键和非极性共价键;H2O2具有弱酸性,第一步电离产生氢离子与HO2-;
(3)酸性条件下H2O2将Cu氧化为Cu2+,同时生成水;
(4)根据反应NaH+H2O═NaOH+H2↑和2H2O+2NaOH+2Al═2NaAlO2+3H2↑计算;
(5)Na2O2和H2O反应,然后NaOH、O2、Fe2+反应,Na2O2和Fe2+的物质的量之比为1:2,且无气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3;
(6)NO2分子相互反应有N2O4生成,物质的量减少,平均相对分子质量增大.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,E元素的周期序数与主族序数相等,结合原子序数可知,E只能处于第三周期,故E为Al;D、E同周期,处于第三周期,结合原子序数可知D处于ⅠA族或ⅡA族,而A、D同主族,A、W能形成两种液态化合物A2W和A2W2,A应为H、W为O、D为Na,B的原子序数=40-1-8-11-13=7,则B为N元素,
(1)E元素的盐酸盐或硫酸盐在水中可以水解生成Al(OH)3胶体,Al(OH)3胶体可以吸附水中的悬浮杂质形成沉淀,达到净水的目的,
故答案为:E元素的盐酸盐或硫酸盐在水中可以水解生成Al(OH)3胶体,Al(OH)3胶体可以吸附水中的悬浮杂质形成沉淀,达到净水的目的;
(2)H2O2分子中含有为极性共价键和非极性共价键;H2O2具有弱酸性,第一步电离产生氢离子与HO2-,电离方程式为:H2O2?H++HO2-,
故答案为:极性共价键、非极性共价键;H2O2?H++HO2-;
(3)酸性条件下H2O2将Cu氧化为Cu2+,同时生成水,反应离子方程式为:Cu+2H++H2O2═Cu2++2H2O,
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(4)NaH+H2O═NaOH+H2↑
1mol 1mol 1mol
2H2O+2NaOH+2Al═2NaAlO2+3H2↑
1mol 1mol 1.5mol
故生成生成气体的体积=(1mol+1.5mol)×22.4L/mol=56L,
故答案为:56L;
(5)由于Na2O2和Fe2+的物质的量之比为1:2,反应没有气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
(6)NO2分子相互反应有N2O4生成,物质的量减少,故平均相对分子质量增大,
故答案为:高;NO2分子相互反应有N2O4生成,物质的量减少.
点评 本题考查结构性质位置关系综合应用,涉及盐类水解、化学键、离子方程式、化学计算等,推断元素是解题关键,侧重对基础知识的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2、D2和T2互称为同素异形体 | B. | 35Cl和37Cl 互称为同位素 | ||
| C. |  和 和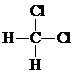 互称为同分异构体 互称为同分异构体 | D. | C2H4与C4H8一定能互称为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
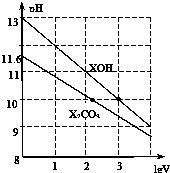 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
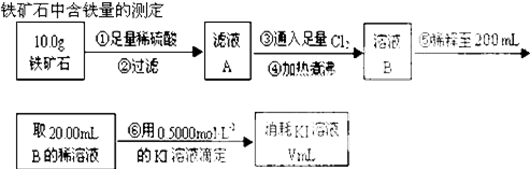
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
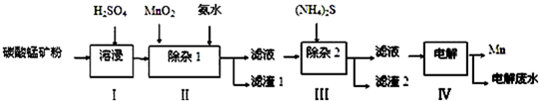
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 可确定该物质中不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
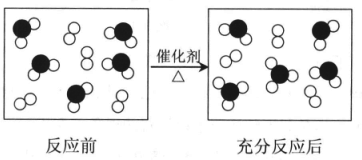
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com